
- •Задание 1 по теме: Термодинамическая характеристика химической реакции Примеры решения задач
- •S характеризует неупорядоченность системы (мера беспорядка).
- •Прод – продукты реакции; исх – исходные вещества;
- •Многовариантные задания
- •Примеры решения задач
- •Окислительно-восстановительные реакции (овр) – химические реакции, в которых происходит изменение степени окисления атомов элементов, входящих в состав реагирующих веществ
- •Окислительно-восстановительная реакция возможна между веществами, одно из которых содержит атом элемента, способный повысить степень окисления, а другое – понизить степень окисления
- •Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем
- •В электронных уравнениях процессов знак стрелки →
- •Многовариантные задания
- •Примеры решения задач
- •Электродом называют систему, состоящую из электронного проводника (металл, графит и др.), находящегося в контакте с ионным проводником (раствор электролита)
- •Металл с меньшим значением электродного потенциала (более активный) способен вытеснять металл с большим значением электродного потенциала (менее активный) из раствора его соли
- •Металл с отрицательным значением стандартного электродного потенциала способен вытеснять водород из кислот, окисляющих катионом водорода (практически все кислоты, кроме н2so4 (конц), нno3)
- •В схеме гальванического элемента слева помещают анод, справа катод
- •Токообразующая реакция суммарная химическая окислительно-восстановительная реакция, протекающая в гальваническом элементе
- •Многовариантные задания
- •Примеры решения задач
- •1) Анионы бескислородных кислот (кроме f −)I−, Br−, s−2, ci−;
- •Анионы движутся к аноду, катионы – к катоду
- •Многовариантные задания
- •Термодинамические свойства некоторых веществ. Приложение 1
- •Стандартные электродные потенциалы металлов
Прод – продукты реакции; исх – исходные вещества;
ni – стехиометрические коэффициенты в уравнении реакции
Исходные вещества в данной реакции – C2H5ОН(г) и О2(г); продукты реакции – СО2(г) и Н2О(г).
Учитывая значения (298) и стехиометрические коэффициенты для всех веществ, участвующих в реакции, получаем:
= (2DH0(СО2) + 3DH0(Н2О)) – (DH0(С2Н5ОН) + 3DH0(О2)) =
(2·(–393,51) + 3(–241,81)) – ((–234,80) + 3·0) = – 1277,62 кДж.
< 0, реакция протекает с выделением теплоты, т. е. является экзотермической. Действительно, данная реакция относится к реакциям горения (взаимодействие с кислородом), всегда протекает с выделением теплоты (является экзотермической).
Рассчитаем энтропию химической реакции , используя значения S0(298) для всех веществ, участвующих в реакции.
Значения
и
можно
рассчитать по уравнению, аналогичному
уравнению для расчёта
=
∑
 (прод) – ∑
(исх);
(прод) – ∑
(исх);
=
∑
 (прод)
– ∑
(исх)
(прод)
– ∑
(исх)
= (2S0(СО2) + 3S0(Н2О)) – (S0(С2Н5ОН) + 3S0(О2)) = (2·213,66 + 3·188,72) – (281,38 + 3·205,01) = 96,95 Дж/К = 0,09695 кДж/К.
Так как > 0, реакция протекает с увеличением беспорядка в системе (неупорядоченность системы увеличивается). Действительно, в данной реакции из 4 молекул газов (1 молекулы С2Н5ОН и 3 молекул О2) образуется 5 молекул газов (2 молекулы СО2 и 3 молекулы Н2О), поэтому реакция протекает с увеличением беспорядка в системе. Рассчитаем изменение энергии Гиббса химической реакции , используя значения (298) для всех участвующих в реакции веществ:
= (2DG0(СО2) + 3DG0(Н2О)) – (DG0(С2Н5ОН) + 3DG0(О2)) = = (2·(–394,37) + 3(–228,61)) – ((–167,96) + 3·0) = –1306,61 кДж.
можно рассчитать по уравнению Гиббса:
= – Т = –1277,62 – 298(–0,09695) = –1306,51кДж.
Величины DG0r(298), рассчитанные двумя способами, как правило, практически совпадают, если расчёты верны.
Так как < 0, при стандартных условиях реакция самопроизвольно протекает в прямом направлении.
Определим, является ли данная реакция обратимой.
Используя уравнение Гиббса и знаки Hr и Sr (Hr < 0 и Sr > 0), определим знаки при высоких и низких температурах и направление протекания реакции (см. пример 1).
Gr < 0, протекает прямая реакция;
Gr < 0, протекает прямая реакция.
Так как при любых температурах данная реакция протекает только в прямом направлении, следовательно, является необратимой.
Пример
1.3. В системе протекает реакция :
 ,
,
для которой при 298 К = – 681,25 кДж; = – 8,64 Дж/К. Определите, реакция обратима или необратима. Рассчитайте равновесную температуру, если она обратима. Схематически изобразите зависимость энергии Гиббса реакции от температуры.
Решение. Для оценки обратимости исследуемой реакции необходимо определить, может ли она протекать в прямом и обратном направлении, то есть необходимо выяснить, может ли Gr при различных температурах (низких и высоких) изменять знак на противоположный (см. пример 1.1).
Математический анализ уравнения Гиббса позволяет сделать следующие выводы. Если знаки H и S одинаковы (> 0 или < 0), то G при (низкие температуры) и (высокие температуры) изменяет знак.
Если знаки H и S противоположны, то при любых температурах
знак G одинаков (либо > 0, либо < 0)
По условию задачи < 0 и < 0, то есть данная реакция является экзотермической и протекает с уменьшением беспорядка в системе, действительно, из 2,5 молекул газов (5/2 молекул O2 )образуется 2 молекулы газов (2 молекулы SO2). Так как знаки и одинаковы, то Gr при различных температурах (низких и высоких) может изменять знак на противоположный.
при < 0, протекает прямая реакция,
а при > 0, протекает обратная реакция.
Так как данная реакция может протекать как в прямом, так и в обратном направлении, то является обратимой.
В состоянии равновесия G = 0, из уравнения Гиббса 0 = Н – Тр S,
Тр = Н / S, Тр – равновесная температура
Рассчитаем равновесную температуру Тр, для этого выразим величины и в одинаковых единицах (кДж): Тр = / = – 681,25/ – 8,64 ∙10–3 = 78848 К.
Реально достижимой является температура, не выше 3000 К. Рассчитанная равновесная температура очень высока, поэтому практически нереализуема, то есть реально данная реакция может протекать только в прямом направлении.
Используя данные анализа уравнения Гиббса и величину равновесной температуры, схематически изобразим график зависимости энергии Гиббса реакции от температуры (рис. 1).






 Т,
К
Т,
К
0 298 78848
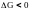
Рис. 1. Зависимость энергии Гиббса химической реакции от температуры
Следовательно,
при
 К самопроизвольно протекает прямая
реакция, а при
К самопроизвольно протекает прямая
реакция, а при
 К
самопроизвольно протекает обратная
реакция.
К
самопроизвольно протекает обратная
реакция.
