
- •Розділ 1. Клональна природа імунної відповіді
- •Імунітет і захворювання
- •Інструктивна версія селекційних теорій утворення антитіл
- •П. Ерліх і теорія бокових ланцюгів
- •Ф.Харовіц і матрична теорія
- •1.2.3. Н.Йерне, д.Таллмадж та м.Бернет: Клональна селекція
- •Розділ 2. Природа антигенів
- •2.2.2 Специфічність серологічних реакцій
- •2.2.3 Перехресна реактивність
- •2.3 Антитіла до білків
- •2.3.1 Роль просторової конфігурації і послідовності амінокислот в антигенності
- •Амінокислотна послідовність і просторова структура лізоциму, що визначає його антигенність
- •2.3.2 Роль рухливості сегментів
- •2.3.3 Гіпотеза множинності детермінант
- •Розділ 3. Основний мономер імуноглобуліну
- •3.1. Антитіла та імуноглобуліни
- •3.2 Ланцюгова структура імуноглобуліну
- •3.2.1 Ранні дослідження з використанням антисироватки: очистка з використанням протеолітичних ферментів
- •3.3 Структурна основа різноманітності антитіл
- •3.3.1 Константні і варіабельні ділянки
- •3.3.2. Гіперваріабельні ділянки
- •3.5 Природа антиген-звязуючої ділянки
- •Розділ 4. Гетерогенність імуноглобулінів
- •Властивості класів імуноглобулінів
- •Розділ 5. Структура генів імуноглобулінів
- •На рисунку 10 показано один із можливих механізмів забезпечення такої різноманітності, а саме відображено механізм поєднання V I j в ланцюг.
- •5.2 Гени константних ділянок
- •Розділ 6. Оцінка реакцій а/г – а/т
- •6.1 Комплекс антиген/антитіло
- •Розділ 7. Комплемент
- •7.1 Відкриття системи комплементу
- •7.2 Класичний шлях активації комплементу
- •9.3 Альтернативний шлях активації
- •Розділ 8. Гемопоез
- •8.1 Походження колоній від однієї клітини
- •Розділ 9. Організація і структура лімфоїдної тканини
- •9.1 Структура лімфоїдних органів
- •9.1.1 Тимус
- •9.2 Селезінка
- •9.1.3 Лімфоїдні судини і лімфоїдні вузли
- •9.1.4 Циркуляція лімфоцитів
- •9.1.5 Ділянки в і т клітин в лімфоїдних органах
- •Розділ 10. Головний комплекс гістосумісності
- •10.1 Відкриття гкг (mhc)
- •10.2 Ознаки, що контролюються гкг
- •10.3 Картування генів гкг за функціями
- •10.4 Поліморфізм гкг
- •10.5 Структура молекул гкг
- •10.5.1 Молукули класу і
- •10.5.2 Молекули класу іі
- •10.6 Суперродина імуноглобулінів
- •Список використаної літератури
3.3.2. Гіперваріабельні ділянки
В1970 році Ву та Кабат визначили рівень варіабельності,V:
V=число різних амінокислот в даній позиції/ частота найбільш звичайних АК в даній позиції. Ділянки варіабельності називаються гіперваріабельними, а ділянки з низькою варіабельністю – каркасними ділянками.
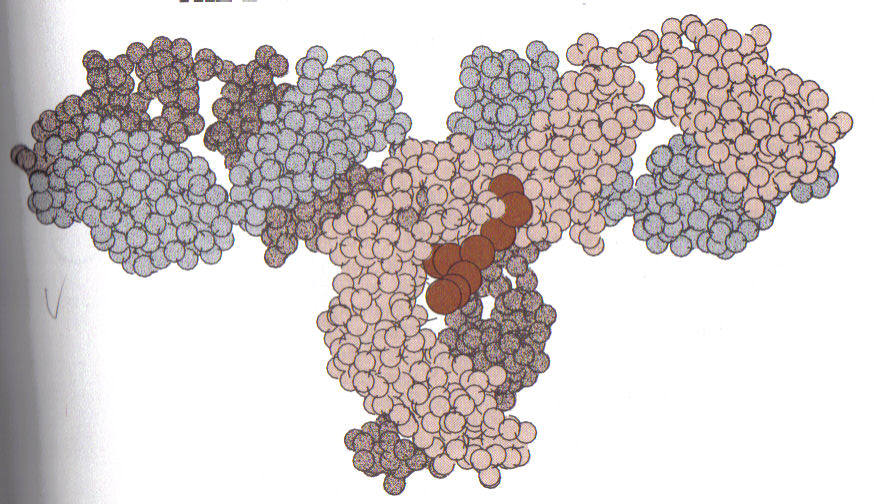
Рисунок 5. Трьох вимірна структура IgG людини
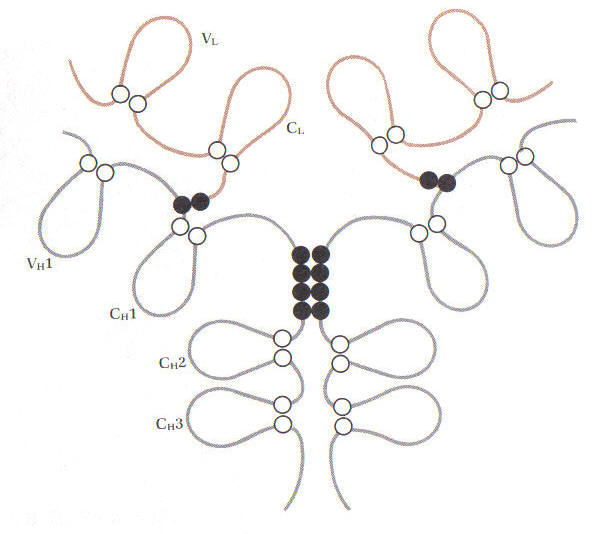
Рисунок 6. Молекула IgG2 людини
3.5 Природа антиген-звязуючої ділянки
Антиген-звязуюча
ділянка має вигляд жолобу або порожнини
і складається з частин гіперваріабельних
ділянок важкого і легкого ланцюгів
(рис. 7 і 8).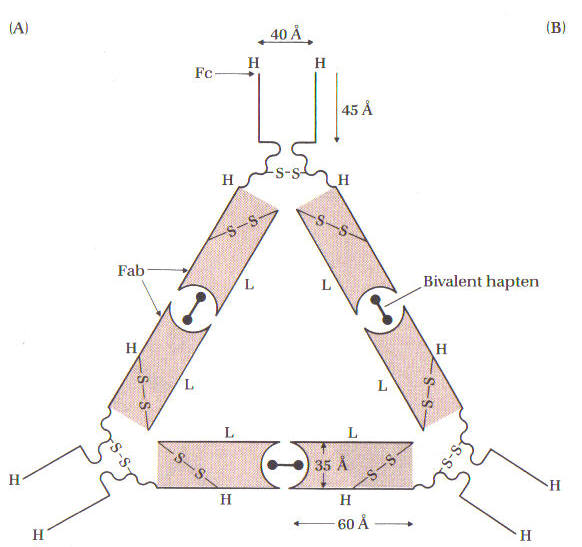
Рисунок 7. Анти -2,4-динітрофенол антитіло кролика і бівалентний гаптен
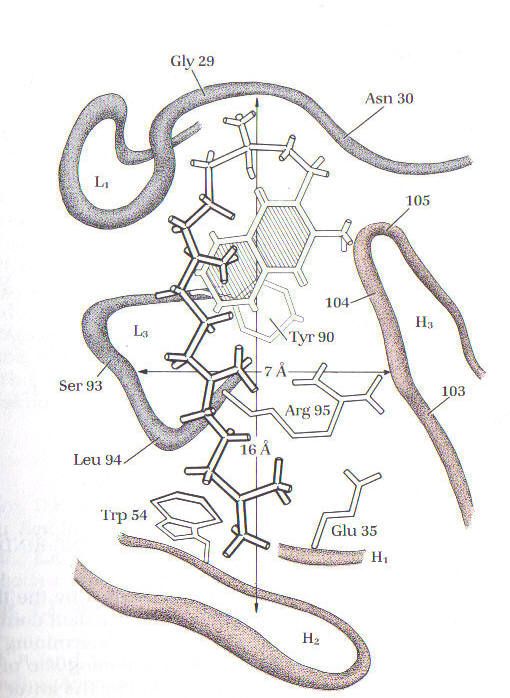
Рисунок 8. Антиген-звязуюча ділянка молекули антитіла
Розділ 4. Гетерогенність імуноглобулінів
Властивості класів імуноглобулінів
IgG. Імуноглобуліни класу G (рис. 5-6). Є мономером, містить два ланцюги, і два L ланцюги, має коефіцієнт седиментації 7, молекулярна вага приблизно 150.000 дальтон, становить 75% від загального числа імуноглобулінів. Має підкласи IgG1, IgG2, IgG3 і IgG4. Лише даний клас імуноглобулінів здатний проникати через плаценту і міститься в материнських антитілах, що захищають новонародженого.
IgM. Становить близько 10% від загальної кількості сироваткових імуноглобулінів. Коефіцієнт седиментації 19, молекулярна вага від 850.000 до 1.000.000 дальтон. Молекула багата на карбогідрати – близько 12% від ваги. Є пентамером із мономерних ланцюгів (рис. 9). Кожен мономер має вагу близько 180.000 дальтон. Подібно до інших класів імуноглобулінів, за вийнятком IgE, має 4 Сн домени. Першим реагує на появу інфекційного агента.
Рисунок 9. Імовірна локалізація J ланцюга в IgM людини
IgА. Розрізняють сироватковий і секреторний IgА. 20% від загального вмісту сироваткових імуноглобулінів, 80% з цього – мономер із молекулярною вагою 160.000. Решта 20% - полімер, може бути два-, три- і тетра- і пентамер, де мономери пов’язані дисульфідними мостиками. Відповідні полімери мають такі коефіцієнти седиментації: 10, 13 і 15, де 10 – є домінуючим.
Секреторний IgА. Імуноглобулін мукозної секреції. Має чотири компоненти: димер з двох мономерних молекул, 70.000 дальтон секреторний компонент, і 15.000 дальтонний J ланцюг.
IgD. Концентрація цього імуноглобуліну в сироватці крові є надзвичайно низькою, близько 0.03%. Є мало вивченим, молекулярна вага 180.000 дальтон, ланцюг має молекулярну вагу від 60.000 до 70.000 дальтон, з 12% карбогідратів, що асоційовані саме із цим ланцюгом. Біологічні функції слабо вивчені, знайдено на поверхні В лімфоцитів разом із IgM.
IgE. Відноситься до гомоцитотропних чи, інакше, реагуючих антитіл, що включені в регуляцію гіперчутливості і алергії. Має найменшу концентрацію в сироватці крові (0.00005 мг/мл), не дивлячись на це характеризується значною ефекторною функцією. Є мономером (22, 22) з молекулярною вагою 180.000 дальтон. ланцюг має вагу 72.000 і аналогічно до IgM має чотири Сн домени.
Розділ 5. Структура генів імуноглобулінів
5.1. V-D-J зв'язок формує варіабельну ділянку важкого ланцюга
Щоб зрозуміти як продукується така різноманітність імунної відповіді треба прийняти до уваги наступне:
Два протилежні гіпотетичні напрямки лежать в основі – (1) версія генів від зародження проти (2) механіму соматичних мутацій.
гени для кожної антитільної специфічності є представлені в вихідній генетичній лінії, отже кожна клітина має всі гени для всього можливого репертуару антитіл.
Аргумент не на користь попереднього положення приводять прихильники механізму соматичних мутацій – найменше повинно бути 106-108 специфічностей або і 109, що вимагатиме відповідно консервації такої інформації в ДНК – що позбавлене біологічного сенсу. Тому згідно цієї гіпотези, кількість генів від зародження є малою, але в процесі диференціації в лімфоцити ці гени піддаються соматичним мутаціям, що і забезпечує понаднормову різноманітність імунної відповіді.
