
- •Розділ 1. Клональна природа імунної відповіді
- •Імунітет і захворювання
- •Інструктивна версія селекційних теорій утворення антитіл
- •П. Ерліх і теорія бокових ланцюгів
- •Ф.Харовіц і матрична теорія
- •1.2.3. Н.Йерне, д.Таллмадж та м.Бернет: Клональна селекція
- •Розділ 2. Природа антигенів
- •2.2.2 Специфічність серологічних реакцій
- •2.2.3 Перехресна реактивність
- •2.3 Антитіла до білків
- •2.3.1 Роль просторової конфігурації і послідовності амінокислот в антигенності
- •Амінокислотна послідовність і просторова структура лізоциму, що визначає його антигенність
- •2.3.2 Роль рухливості сегментів
- •2.3.3 Гіпотеза множинності детермінант
- •Розділ 3. Основний мономер імуноглобуліну
- •3.1. Антитіла та імуноглобуліни
- •3.2 Ланцюгова структура імуноглобуліну
- •3.2.1 Ранні дослідження з використанням антисироватки: очистка з використанням протеолітичних ферментів
- •3.3 Структурна основа різноманітності антитіл
- •3.3.1 Константні і варіабельні ділянки
- •3.3.2. Гіперваріабельні ділянки
- •3.5 Природа антиген-звязуючої ділянки
- •Розділ 4. Гетерогенність імуноглобулінів
- •Властивості класів імуноглобулінів
- •Розділ 5. Структура генів імуноглобулінів
- •На рисунку 10 показано один із можливих механізмів забезпечення такої різноманітності, а саме відображено механізм поєднання V I j в ланцюг.
- •5.2 Гени константних ділянок
- •Розділ 6. Оцінка реакцій а/г – а/т
- •6.1 Комплекс антиген/антитіло
- •Розділ 7. Комплемент
- •7.1 Відкриття системи комплементу
- •7.2 Класичний шлях активації комплементу
- •9.3 Альтернативний шлях активації
- •Розділ 8. Гемопоез
- •8.1 Походження колоній від однієї клітини
- •Розділ 9. Організація і структура лімфоїдної тканини
- •9.1 Структура лімфоїдних органів
- •9.1.1 Тимус
- •9.2 Селезінка
- •9.1.3 Лімфоїдні судини і лімфоїдні вузли
- •9.1.4 Циркуляція лімфоцитів
- •9.1.5 Ділянки в і т клітин в лімфоїдних органах
- •Розділ 10. Головний комплекс гістосумісності
- •10.1 Відкриття гкг (mhc)
- •10.2 Ознаки, що контролюються гкг
- •10.3 Картування генів гкг за функціями
- •10.4 Поліморфізм гкг
- •10.5 Структура молекул гкг
- •10.5.1 Молукули класу і
- •10.5.2 Молекули класу іі
- •10.6 Суперродина імуноглобулінів
- •Список використаної літератури
Амінокислотна послідовність і просторова структура лізоциму, що визначає його антигенність
2.3.2 Роль рухливості сегментів
Відносно недавні дослідження в Англії показали, що і рухливість/зміна локалізації сегментів антигенної молекули теж впливає на її антигенність. Було ідентифіковано у вірусі тютюнової мозаїки (ВТМ) сім антигенних детермінант, кожна з яких містить п’ять-десять аміногруп. Оскільки ВТМ може бути кристалізований і аналізований за допомогою ренгенівського опромінення/дифракції, то було можливим показати, що шість із семи детермінант мали високий температурний фактор вподовж їх поліпептидного скелету, що означає/вказує на їх високу сегментну мобільність.
На рисунку 4 показано модель молекули інсуліну, відповідно світліші зони характеризуються більшою мобільністю, ніж темніші.
2.3.3 Гіпотеза множинності детермінант
Оскільки було доведено, що амінокислотна послідовність і їх просторове розміщення відіграють важливу роль в антигенності молекули, і їх сегментна мобільність є визначальною,
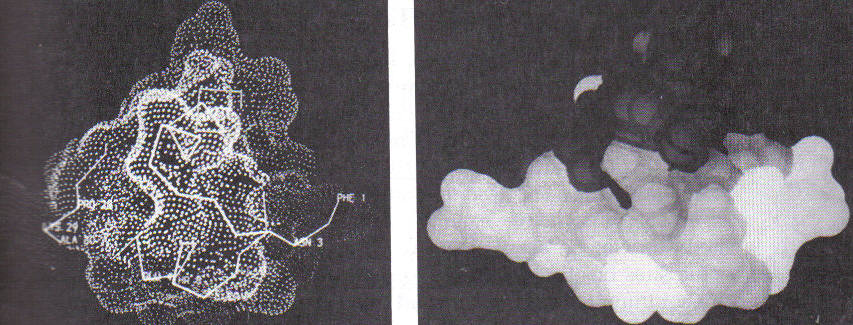
Рисунок 4. Комп’ютерно-графічне зображення інсуліну
це дозволило обгрунтувати гіпотезу наяності у антитілі потенційних антигенних місць/сайтів впізнавання – антигенних детермінант.
Саме антигенні детермінанти антитіл – місця антитіл високої мобільної активності – здатні реагувати з антигенами.
Розділ 3. Основний мономер імуноглобуліну
3.1. Антитіла та імуноглобуліни
В класичному експерименті Тізеліуса та Кабата (1939 р) з використанням методу електрофорезу, автори продемонстрували збільшення гамма-глобулінової фракції сироватки крові імунізованих тварин. Адсорбція сироватки антигеном знижувала кількість білку в даній фракції до рівня інтактних тварин. Як виявилось пізніше, імунологічна активність є єдиною функцією γ-глобулінів, тому цю групу молекул назвали імуноглобулінами (KIndt,T.J., J.D.Capra, 1984).
3.2 Ланцюгова структура імуноглобуліну
3.2.1 Ранні дослідження з використанням антисироватки: очистка з використанням протеолітичних ферментів
Едельман і Портер діючи на антитіла кроликів протеолітичним ферментом – папаїном – і внаслідок розриву дисульфідних зв’язків, отримали 3 фрагменти: 2 –зв’язували антиген (Fab-antigen binding fragment), 3-ій не зв’язував антиген, але кристалізувався і був названий Fc фрагментом. Нісоноф діючи на молекулу антитіла пепсином отримав фрагмент Fab2, дисульфідні мостики при цьому не розривались (Davies,D.R., H. Metzger, 1983).
3.3 Структурна основа різноманітності антитіл
3.3.1 Константні і варіабельні ділянки
При визначенні амінокислотної послідовності моноклональних імуноглобулінів було встановлено, що N-кінцеві ділянки як легких (L), так і важких (H) ланцюгів досить різноманітні, у той час як інші ділянки – відносно незмінні і їх можна розділити на обмежене число доменів. Таким чином, прийнято говорити про варіабельні та константні області легких і важких ланцюгів. Для позначення варіабельних і константних ділянок використовують терміни "V- ділянка" і "C-ділянка ", відповідно. "VL" і "CL" - позначення цих ділянок у легкому ланцюзі, а "VH" і "CH" - у важкому ланцюзі. Важливість цього відкриття не можна переоцінити: адже таким чином основна 4 ланцюгова структура молекули антитіла може дати початок астрономічному числу різних молекул. Отже, варіабельні ділянки відповідають за різноманітність і специфічність антитіл (Glynn,L.E, M.W. Steward, 1981).
Так було відкрито структуру основних класів імуноглобулінів (рис. 5 і 6).
