
1/2 РКдис

Рис.5. Зависимость рН раствора кислоты от ее концентрации
ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
РАБОТА 1
Измерение ЭДС гальванического элемента и электродных потенциалов
Необходимые материалы и оборудование:
растворы СuSO4, ZnS04, CdSO4, концентрация I моль/кг,
стаканы на 50-100 мл, мерные колбы на 50 мл,
пипетки на I и 5 мл,
мерный цилиндр на 2§ мл,
электролитический ключ,
наждачная бумага,
металлические электроды (Си,2п» Cd),
хлорсеребрянный (или каломельный) электрод,
высокоомный потенциометр Р-307 с гальванометром , элементом Вестона и аккумулятором (или батареей сухих элементов), -
термостат
дистиллированная вода.
Для проведения работы собирают гальванический элемент, состоящий из двух металлических электродов (Си,Zu, Cd) no заданию преподавателя. Поверхность электродов зачищают наждачной бумагой, тщательно промывают водопроводной водой и споласкивают дистиллированной водой. Приготовленные таким образом электроды опускают в стаканы объемом 50 мл, куда предварительно заливают раствор соли заданной концентрации.
электролитический ключ заполняют насыщенным раствором хлористого калия (или 0,1 моль/л раствором азотнокислого калия) и помещают в электродные сосуды непосредственно перед измерениями.
Гальванический- элемент помещают в термостат на 15-20 мин нут и присоединяют к соответствующим клеммам потенциометра Р-307.
Для определения знака заряда электродов химических гальванических элементов пользуются таблицей стандартных значений потенциалов электродов» а для концентрационных элементов знаки зарядов электродов определяют по концентрации электролитов (положительным электродом будет тот, где выше концентрация электролита).
Последовательность операций при измерении ЭДС потенциометром Р--307:
- присоединить к соответствующим клеммам потенциометра гальванометр, нормальный элемент Вестона батарею сухих элементов и исследуемый гальванический элемент;
- переключатель вида работ поставить в положение НЭ, Кратковременным нажатием кнопки "430 кОм" включить гальванометр в цепь в которой ведутся измерения и вращением ручек "регулировка тока" добиться такого положения, когда при нажатии кнопки "430 кОм" стрелка гальванометра не отклоняется. Затем кратковременно нажимая кнопку "0" произвести более точную компенсацию;
- переключатель вида работ поставить в положение " X1" или " X2" в зависимости от того, к каким клеммам подсоединен исследуемый элемент, и вращая ручки декадных реостатов, добиться компенсации ЭДС исследуемого элемента. Значение ЭДС отсчитывать в смотровых окошечках потенциометра.
Для определения потенциала каждого из электродов составить гальванический элемент, состоящий из электрода, потенциал которого определяется, и электрода сравнения (каломельного или хлорсеребрянного) и измерить его ЭДС. По определенному ЭДС и известному потенциалу электрода сравнения рассчитать потенциал исследуемого электрода.
То же самое проделать со вторым электродом. Но полученными значениям электродных потенциалов обоих электродов рассчитать ЭДС.
Рассчитать ЭДС исследуемого элемента по уравнению Нернста, для этого написать суммарное уравнение реакции, протекающей в элементе.
Сравнить все три значения ЭДС.
РАБОТА 2
Определение констант диссоциации слабых кислот путем измерения рН растворов.
Н еобходимые
материалы и оборудование:
еобходимые
материалы и оборудование:
- растворы слабых кислот, концентрации I моль/л (уксусная, муравьиная, пропионовая, щавелевая, фосфорная и др.),
стаканы на 50 и 100 мл,
мерные колбы на 50 мл,
пипетка на 10 мл,
мерный цилиндр на 25 мл,
электролитический ключ,
платиновый электрод,
хлорсеребрянный (или каломельный) электрод,
хингидрон,
дистиллированная вода,
потенциометр Р-307 с нормальным элементом Вестона, батареей сухих элементов, гальванометром. –
Из исходного раствора слабой кислоты (указывается преподавателем) с концентрацией 1,0 моль/л путем последовательного разведения готовят растворы следующих концентраций, (моль/л): 0,5, О,1, 0,05, 0,01, 0,005, 0,001. Объем раствора должен быть не менее 25 мл и не более 50 мл,
В стаканчик на 50 мл налить 25 мл приготовленного раствора кислоты, добавить хингидрон. Раствор тщательно перемешать стеклянной палочкой. Хингидрона добавляют столько, чтобы образовался насыщенный раствор. Опускают в стаканчик платиновый и хлорсеребрянный электроды и измеряют ЭДС полученного гальванического элемента. По величине ЭЬДС рассчитывают рН раствора.
Такие же измерения проводят со всеми приготовленными растворами.
Полученные результаты сводят в таблицу

На основе опытных данных построить график в координатах рН = рН(IgСША) и определить константу диссоциации слабой кислоты. Сравнить значение константы диссоциации, найденное из опытных данных, со справочным значением.
РАБОТА 3
Определение констант диссоциации слабых кислот потенциометрическим титрованием.
Необходимые материалы и оборудование:
растворы слабых кислот концентрации 0,1 моль/л,
стаканы на 150-200 мл,
пипетка на; 10 мл,
бюретка на 25 мл,
хингидрон,
раствор NаОН концентрации 0.1моль/л,
платиновый электрод,
хлорсеребрянный электрод,
дистиллированная вода,
потенциометр Р-307 с нормальным элементом Вестона, гальванометром и батареей сухих элементов,
магнитная мешалка.
Для потенциометрического титрования слабой кислоты готовится элемент, состоящий из хингидронного и хлорсеребрянного электродов:
Ag | AgCl| KCl || р-р слабой кислоты насыщ. хингидроном | Pt
Измерительная ячейка, используемая при этом, изображена на рис.6.
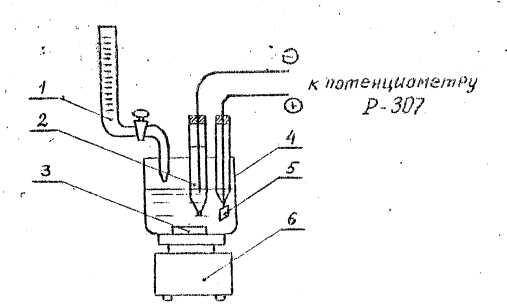
Рис.6. Ячейка для потенциометрического титрования:
I - бюретка
2 - хлорсеребрянный электрод
3 - элемент магнитной мешалки
4 -стакан,
5 - платиновый электрод
6 - магнитная мешалка
В стакан для титрования емкостью 150-200 мл вводят пипеткой 10 мл 0.1 моль/л водного раствора слабой кислоты (кислота задается преподавателем) и разводится дистиллированной водой примерно до половины стакана/ В раствор добавляют хингидрон до насыщения, опускают платиновый и хлорсеребрянный электроды, подсоединенные к соответствующим клеммам потенциометра. Стакан устанавливают на магнитную мешалку.
Измеряют ЭДС полученного гальванического элемента после каждой порции прилитой щелочи. Концентрация щелочи 0,1моль/л. Первые пять порций взять по1 мл, в дальнейшем объем порции уменьшить до 0,5 мл. Опыт заканчивается после приливания 15 мл щелочи.
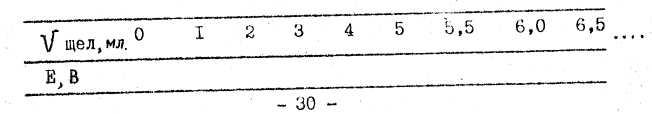 Полученные
результаты свести в таблицу
Полученные
результаты свести в таблицу
По табличным данным построить график Е = f(Vщел) и определить E1/2 Рассчитать ℓgКдис и Кдис Сравнить полученное значение константы диссоциации со справочной.
РАБОТА 4
Определение термодинамических функций реакции, протекающих в гальваническом элементе.
Необходимые материалы и оборудование:
растворы солей растворы СuSO4, ZnS04, CdSO4, концентрация I моль/кг,
стаканы на 50-I00 мл,
мерные колбы на 50 мл,
пипетки на I и 5 мл,
мерный' цилиндр на 25 мл,
электролитический ключ,
наждачная бумага,
металлические электроды (Сn, Zn Cd)
потенциометр Р-307 с гальванометром, элементом Вестона и батареей сухих элементов,
термостат
дистиллированная вода.
Целью данной работы является определение теплового эффекта, изобарyо-изотермического потенциала, энтропии реакции, протекающей в обратимо работающем гальваническом элементе на основании измерения ЭДС при различных температурах.
При выполненииtэтого задания готовится гальванический элемент (по указанию преподавателя) как в работе I.
Элемент помещают в термостат, выдерживают при заданной температуре 15-20 мин с тем, чтобы температура элемента сила равной температуре термостата и производят измерение ЭДС компенсационным методом. Изменяют температуру воды в термостате 'и после выдержки 15-20 минут вновь проводят измерение ЭДС.
Рекомендуются пределы температуры от 20 до 60°С, а интервал 7-10°С Измерения долены быть проведены не менее, чем при четырех значениях температуры.

Температурный коэффициент удобно находить графическим способом, для этого строят график зависимости ЭДС от температуры и по угловому коэффициенту прямой определяют ( ∂E/∂T)р. По уравнениям (15), (12) и (10) рассчитать ΔНт, ΔSт и ΔGт
ЛИТЕРАТУРА
Киреев В.В. Курс физической химии, - М.1975.
2. Стромберг А.Г., Семченко Д П, Физическая химия - М. Высшая школа, 1988.
3. Физическая химия /Под ред. Краснова К.С. - М,; Высшая школа, 1982. .
4. Краткий справочник физико-химических величин /Под ред. Равделя А.А. и Пономаревой A.M. Л, Химия, 1983, .
Добош Д. Электрохимические константы.- М., Мир, I980.
Практические работы по физической химии /Под ред.Мищенко К.П., Равделя А.А., Пономаревой A.М. - Л, Химия, 1982.
Практикум по физической химии /Под ред. Кудряшова И.В. Высшая школа, 1986
Практикум но физической химии /Под ред. Буданова В.В., Воробьева П.К. - М. Химия, 1986.

Таблица 2
Потенциалы насыщенных каломельного и хлорсеребрянного электродов при различных температурах


СОДЁГЖ/ШИЕ
ВВЕДЕНИЕ 3
