
- •Содержание
- •Соли кислородсодержащих кислот.
- •Соединения с галогенами.
- •Тиоцианаты.
- •Соединения с неметаллами.
- •Сплавы с металлами.
- •Соединения с органическими лигандами
- •Сырьевые источники циркония и гафния.
- •Мировые запасы циркония по оценке Геологической службы сша (без учета России и стран снг)
- •Методы выделения соединений циркония из растворов выщелачивания.
- •Переработка эвдиалита.
- •Переработка бадделита.
- •Методы разделения циркония и гафния.
- •Получение наноразмерного диоксида циркония
- •Получение металлических циркония и гафния.
- •Получение компактного металла.
- •Рафинирование циркония и гафния.
- •Литература
- •Избранные главы ХиТррэ. Химия и технология циркония и гафния.
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Московский Государственный университет тонких химических технологий им. М.В.Ломоносова
Кафедра химии и технологии редких и рассеянных элементов
им. чл.-кор. АН СССР
К.А.Большакова
ДРОБОТ Д.В., ЛЫСАКОВА Е.И., РЕЗНИК А.М.
ИЗБРАННЫЕ ГЛАВЫ ХиТРРЭ.
ХИМИЯ И ТЕХНОЛОГИЯ ЦИРКОНИЯ И ГАФНИЯ.
УЧЕБНОЕ ПОСОБИЕ.
Москва 2013 г.
ББК 34.33
УДК 669.7/8 : 66.01
Рецензент: проф., д.х.н. Вольдман Г.М. (МИТХТ, кафедра химии и технологии наноразмерных и композиционных материалов)
ДроботД.В., Лысакова Е.И., Резник А.М.
Избранные главы ХиТРРЭ. Химия и технология циркония и гафния.
Учебное пособие. М.: МИТХТ им. М.В. Ломоносова, 2013., 88с.
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В. Ломоносова в качестве учебного пособия.
Учебное пособие содержит материалы для углубленного изучения студентами дисциплины «Физико-химические основы технологии редких элементов». В него вошли вопросы, посвященные химии и технологии циркония и гафния. Учебное пособие рекомендовано для студентов 4-го курса, обучающихся по образовательной программе 150100.62 «Материаловедение и технологии материалов» и по образовательной программе 240603.65 «Химическая технология редких элементов и материалов на их основе».
МИТХТ им. М.В. Ломоносова, 2013
Содержание
Химия циркония и гафния и их соединений |
5 |
Физические и химические свойства циркония и гафния |
5 |
Свойства соединений циркония и гафния |
8 |
Соединения с кислородом |
8 |
Соли кислородсодержащих кислот |
14 |
Соединения с галогенами |
18 |
Тиоцианаты |
25 |
Соединения с неметаллами |
26 |
Сплавы с металлами |
29 |
Органические соединения |
30 |
Технология циркония и гафния |
33 |
Области применения и конъюнктура рынка циркония и гафния |
33 |
Сырьевые источники циркония и гафния |
43 |
Переработка циркона |
46 |
Методы разложения цирконовых концентратов |
47 |
Методы выделения соединений циркония из растворов выщелачивания |
54 |
Переработка эвдиалита |
61 |
Переработка бадделита |
64 |
Методы разделения циркония и гафния |
66 |
Получение наноразмерного диоксида циркония |
73 |
Получение металлических циркония и гафния |
76 |
Получение компактного металла |
80 |
Рафинирование циркония и гафния |
82 |
Литература |
85 |
Как многие редкие элементы открыты цирконий и гафний довольно поздно. Так в 1789 г. член Берлинской академии наук Мартин Генрих Клапрот опубликовал результаты анализа драгоценного камня, привезенного с берегов Цейлона. В ходе этого анализа было выделено вещество, которое Клапрот назвал цирконовой землей. Происхождение этого названия объясняют по-разному. Одни находят его истоки в арабском слове «заркун», что значит минерал, другие считают, что слово «цирконий» произошло от двух персидских слов «цар» – золото и «гун» – цвет (из-за золотистой окраски драгоценной разновидности циркона – гиацинта). Через 35 лет после опытов Клапрота известнейшему шведскому химику Йенсу Якобу Берцелиусу удалось получить металлический цирконий. Поскольку у гафния собственных минералов нет, то его открытие состоялось практически на два столетия позже. Существование гафния было предсказано Д.И. Менделеевым в 1870 году. В 1921 году Н. Бор показал, что элемент № 72 должен иметь строение атома, подобное цирконию, и что, следовательно, его надо искать не среди редкоземельных элементов, как думали раньше, а среди минералов циркония. Венгерский химик Д. Хевеши и голландский физик Д. Костер систематически исследовали минералы циркония методом рентгеноспектрального анализа и в 1922 году обнаружили элемент № 72, назвав его гафний по месту открытия - городу Копенгагену (позднее лат. Hafnia).
ХИМИЯ ЦИРКОНИЯ И ГАФНИЯ И ИХ СОЕДИНЕНИЙ.
Цирконий и гафний химические элементы IV группы периодической системы Менделеева; атомные номера 40 и 72 соответственно, атомная масса 91,22 и 178,49. Цирконий имеет пять природных изотопов: 90Zr (51,46%),91Zr (11,23%),92Zr (17,11%), 94Zr (17,4%), 96Zr (2,8%), а гафний шесть с массовыми числами 174, 176-180. Из искусственных радиоактивных изотопов важнейший 95Zr (Т½ = 65 сут); используется в качестве изотопного индикатора.
Физические и химические свойства циркония и гафния.
Цирконий и гафний тугоплавкие (Тºпл = 1850 ºС и 2222ºС соответственно) серебристо-белые металлы с характерным блеском.
Цирконий существует в двух кристаллических модификациях: α-формы с гексагональной плотноупакованной решёткой (а = 3,228; с = 5,120) и β-формы с кубической объёмноцентрированной решёткой (а = 3,61). Переход α β происходит при 862 °C. Плотность α-циркония (20 °C) - 6,45 г/см3; tпл - 1825 °C; tкип - 3580-3700 °C; удельная теплоёмкость (25-100 °С) - 0,291 кДж/(кг x °К) [0,0693 кал/(г x °С)], коэффициент теплопроводности (50 °С) - 20,96 вт/(м x К) [0,050 кал/(см x сек x °С)]; температурный коэффициент линейного расширения (20-400 °С) 0,0000069; модуль упругости (20 °С) 97 Гн/м2 (9700 кгс/мм2); предел прочности при растяжении 253 Мн/м2 (25,3 кгс/мм2); твердость по Бринеллю 640-670 Мн/м2 (64-67 кгс/мм2). Удельное электрическое сопротивление циркония высокой степени чистоты (20°С) - 44,1 мком x см.; температура перехода в состояние сверхпроводимости 0,7 °К. Цирконий парамагнитен. Чистый цирконий пластичен, легко поддаётся холодной и горячей обработке (прокатке, ковке, штамповке). Наличие растворённых в металле малых количеств кислорода, азота, водорода и углерода (или соединений этих элементов с цирконием) вызывает хрупкость циркония. При концентрации кислорода в цирконии более 0,2% он уже не поддается холодной обработке давлением. Сечение захвата тепловых нейтронов (0,18±0,004)·10-28м2, примесь гафния увеличивает это значение.
У гафния две модификации. При обычной температуре гафний имеет гексагональную решетку с периодами а = 3,1946Å и с = 5,0511Å. Выше 1740 °C устойчив β-Hf с кубической объемно-центрированной решеткой типа a-Fe (а = 0,3615 нм). Плотность гафния 13,09 г/см3 (20 °С). Атомная теплоемкость 26,3 кдж/(кмоль·К) [6,27 кал/(моль·град)] (25-100°С); удельное электросопротивление 32,4·10-8 ом·м (0°С). Особенность гафния - высокая эмиссионная способность; работа выхода электрона 5,77·10-19 Дж, или 3,60 эв (980-1550°С); Гафний имеет высокое сечение захвата тепловых нейтронов, равное 115·10-28м2, или 115 барн. Чистый гафний, также как и цирконий пластичен, легко поддается холодной и горячей обработке (прокатке, ковке, штамповке).
Цирконий и гафний типичные d- элементы, и внешняя электронная конфигурация их атомов - 4d25s2 и 5d26s2 соответственно. Таким образом, для этих металлов наиболее характерной степенью окисления является +4. Более низкие степени окисления +2 и +3 известны только в соединениях с хлором, бромом и иодом.
Взаимодействие с неметаллами.
Компактный цирконий начинает медленно окисляться в пределах 200-400°С, покрываясь пленкой оксида циркония (IV) ZrO2:
Zr + O2 = ZrO2 (1)
Выше 800°С энергично взаимодействует с кислородом воздуха. Порошкообразный металл пирофорен - может воспламеняться на воздухе при обычной температуре.
Гафний при нормальных условиях устойчив к коррозии из-за образования оксидной пленки HfO2. При нагревании химическая активность гафния возрастает. При температурах выше 700 °C он реагирует с кислородом воздуха:
Hf + O2 = HfO2 (2)
Цирконий активно поглощает водород уже при 300 °С, образуя твердый раствор и гидриды ZrH и ZrH2; при 1200-1300 °С в вакууме гидриды диссоциируют и весь водород может быть удален из металла. При 350—400 °C металлический гафний поглощает водород с образованием гидрида HfH2, выше 400 °C гидрид отдает водород.
С азотом цирконий и гафний образуют при 700-800 °С нитриды ZrN и HfN по реакции:
2Zr(Hf) + N2 = 2Zr(Hf)N (3)
Цирконий взаимодействует с углеродом при температуре выше 900°С с образованием карбида ZrC. Карбид и нитрид циркония - твердые тугоплавкие соединения; карбид циркония - полупродукт для получения ZrCl4.
При высокой температуре гафний взаимодействует с углеродом, бором и кремнием, образуя металлоподобные, тугоплавкие, весьма устойчивые по отношению к химические реагентам соединения: HfB, HfB2 (tпл 3250 °С), HfC (tпл 3887 °С), Hf2Si, HfSi, HfSi2
Цирконий вступает в реакцию с фтором при обычной температуре, а с хлором, бромом и иодом при температуре выше 200 °С, образуя высшие галогениды ZrX4 (где X - галоген).
С галогенами гафний реагирует при нагревании, образуя соединения типа HfX4 (тетрафторид HfF4, тетрахлорид HfCl4 и другие).
Взаимодействие с кислотами и щелочами.
Цирконий взаимодействует с кислотами, если возможно образование его анионных комплексов. Так, мелко раздробленный цирконий растворяется в плавиковой кислоте:
Zr + 6HF = H2[ZrF6] + 2H2 (4)
в смеси азотной и плавиковой кислот:
3Zr + 4HNO3 + 18HF = 3H2[ZrF6] + 4NO + 8H2O (5)
в царской водке:
3Zr + 4HNO3 + 18HCl = 3H2[ZrCl6] + 4NO + 8H2O (6)
Также как и цирконий, гафний взаимодействует с кислотами, только если создаются условия окисления и образования анионных комплексов Hf(IV). Мелко раздробленный гафний растворяется в плавиковой кислоте:
Hf + 6HF = H2[HfF6] + 2H2 (7)
В смеси азотной и плавиковой кислот и в царской водке идут реакции:
3Hf + 4HNO3 + 18HF = 3H2[HfF6] + 4NO– + 8H2O (8) 3Hf + 4HNO3 + 18HCl = 3H2[HfCl6] + 4NO– + 8H2O (9)
С концентрированной серной кислотой гафний взаимодействует только при кипячении:
Hf + 5H2SO4 = H2[Hf(SO4)3] + 2SO2– + 4H2O (10)
Цирконий и гафний устойчивы к растворам щелочей.
Свойства соединений циркония и гафния.
Соединения с кислородом.
Оксиды циркония и гафния.
Цирконий образует только один стабильный оксид ZrO2, есть сведения об образовании еще одного, но нестабильного оксида ZrO. Диоксид циркония обладает высокой стабильностью (tпл= 2690°С), твердостью 6,5 – 8,5 по Моосу, низкой химической активностью. По этим свойствам диоксиды циркония и гафния чрезвычайно схожи.
В системе цирконий – кислород образуется твердый раствор внедрения кислорода в -Zr, при этом растворимость кислорода составляет 29 ат.% для -Zr она меньше. Для гафния растворимость кислорода не превышает 20,5%. Диоксид циркония имеет три высокотемпературные полиморфные модификации: моноклинная (область существования 1000-1050°С), тетрагональная (область существования 1900 - 2300°С) и кубическая (тип флюорита). Переход аморфного диоксида циркония в моноклинную кристаллическую решетку протекает при температуре 450-500°С, остальные переходы обратимые и протекают соответственно при температурах 1100 и >2300°С. При переходе от моноклинной к тетрагональной решетке происходит уменьшение объема на 7,5 – 7,7%, что делает невозможным использование этого диоксида циркония в качестве огнеупорного материала. В кристаллической решетке диоксида циркония и диоксида гафния у цркония (Hf) координационное число 8, а у кислорода – 4, т.е. каждый атом циркония связан с восемью атомами кислорода и соответственно каждый атом кислорода с четырьмя атомами циркония.
Диоксид циркония образует твердые растворы с оксидами кальция (CaO), иттрия (Y2O3) (рис.1), ниодима (Nd2O3), скандия (Sc2O3) и др. при определенных концентрациях оксидов (до 16 – 30 от.%) во всем температурном интервале. При этом кубической решетки диоксида циркония стабилизируется. Это происходит потому, что в твердом растворе большие по размеру ионы кальция (Ca2+) и лантаноидов (La3+) занимают место иона циркония (Zr4+), электронейтральность кристалла сохраняется за счет образования кислородных вакансий. При этом увеличиваются параметры кристаллической решетки и соответственно стабильность решетки. Кроме этого наличие анионных вакансий приводит к увеличению подвижности ионов кислорода и в электрическом поле кристаллы обладают ионной проводимостью (твердые электролиты).
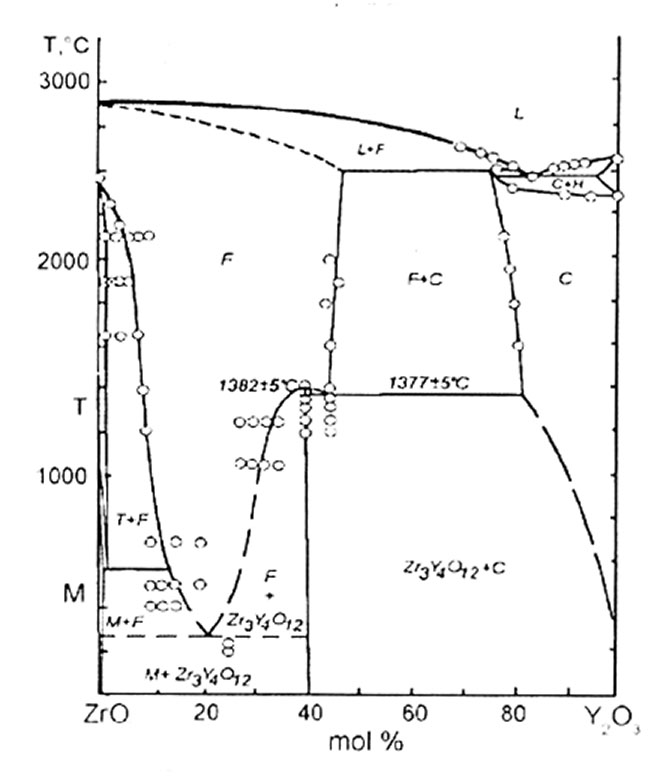
Рис.1
Диаграмма ZrO2 – Y2O3
Диоксид гафния также как и диоксид циркония имеет три полиморфные модификации: моноклинную, тетрагональную и кубическую. При этом переходы протекают при температурах несколько выше, чес у диоксида циркония – 1650 и >2500°С.
Как уже выше отмечалось, диоксиды циркония и гафния обладают низкой химической активностью.
Диоксид ZrO2 не реагирует с водой, концентрированными соляной HCl и азотной HNO3 кислотами. Взаимодействует с концентрированной плавиковой и серной кислотами. С расплавленными щелочами ZrO2 реагирует с образованием солей — цирконатов:
ZrO2 + 2КOH = К2ZrO3 + H2O (11)
Диоксид HfO2 не растворяется в воде, концентрированных соляной и азотной кислотах, но взаимодействует с концентрированной плавиковой и серной кислотами. С расплавленными щелочами HfO2 реагирует с образованием солей — гафнатов:
HfO2 + 2NaOH = Na2HfO3 + H2O (12)
Гидроксиды циркония и гафния.
Гидроксиды циркония и гафния получают осаждением из растворов при рН=1,9-2,5 для циркония и 2,1-2,9 для гафния. Свежеосажденные гелеобразные гидроксиды быстро стареют из-за потери воды. Это приводит к снижению растворимости в кислотах. Эмпирическая формула гидроксидов – Zr(Hf)O(OH)2xH2O. Т.е. по существу эти соединения можно назвать гидроксид-оксид. Все явления, которые происходят при гидролизе растворов циркония и гафния и осаждении их гидроксид-оксидов имеют тот же характер, что и для титана и могут быть объяснены с тех же позиций. Однако нужно отметить следующее:
- цирконий и гафний имеют более выраженные металлические свойства;
- имеют большую склонность к (полимеризации) комплексообразованию.
Поэтому:
- в растворах в определенных условиях (растворы HClO4>2моль/л, сМ = 10-4моль/л) существуют ионы [M(H2O)x]4+. В присутствии ионов комплексообразователей ( NO3-, Cl- и др.) образуются комплексные катионы [M(NO3)]3+,[M(NO3)2]2+, а при уменьшении кислотности появляются ионы [M(OH)]3+. В разбавленных растворах солей преимущественно [M(OH)3]+. О наличии в растворах иона цирконила данных нет.
В концентрированных растворах, наряду с гидролизом протекают процессы гидролитической полимеризации и образования оловых соединений. Однако эти процессы не заходят так глубоко как в случае титана. В растворах солей циркония и гафния наиболее вероятно существование димерных, тримерных и тетрамерных комплексных катионов с эмпирической формулой [Zr4(OH)8(H2O)16]+8 (хлориды, бромиды, сульфаты), имеющих определенную структуру (рис 2.).
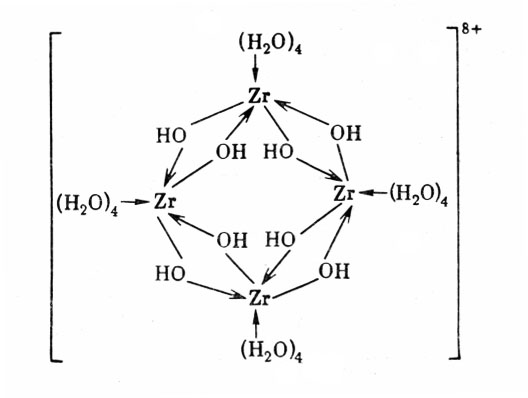
Рис.2
Структура комплексного катиона [Zr4(OH)8(H2O)16]+8
Структура в ряде случаев сохраняется и в твердых солях (хлориды). При гидролизе, даже при нагревании раствора осадки гидроксидов, как правило, не образуются. Исключение составляют нитратные растворы, в которых образуются цепочечные полимеры, а при нагревании наблюдается частичное выпадение циркония в виде гидроксидов.
В присутствии сильных комплексообразователей – лимонной, винной кислот и др. гидроксид не осаждается, даже из сильно щелочных растворов.
Твердые соединения циркония и гафния (ZrOCl28H2O, Zr(SO4)24H2O, xZrO2ySO3zH2O) при обработке растворами аммиака или щелочей (NaOH, KOH) превращаются в маловодные гидроксиды, содержащие до 65-70% диоксида циркония или 70-75% диоксида гафния. Маловодные гидроксиды, полученные по указанной методике, представляют собой мелкодисперсные хорошо фильтруемые порошки, медленно стареющие на воздухе и сохраняющие длительное время способность растворяться в концентрированных кислотах.
Необходимо отметить, что при старении гидроксидов циркония и гафния наблюдаются те же явления, что и при старении гидроксида титана.
При нагревании гидроксидов циркония вначале они переходят в аморфный диоксид циркония, а затем при температуре 400-500°С в тетрагональную (метастабильную) модификацию диоксида циркония и при дальнейшем повышении температуры до 600°С в моноклинную модификацию.
Гидроксид гафния сразу при температуре 520-540°С переходит в моноклинную модификацию диоксида гафния, вследствие меньшей склонности к образованию метастабильных фаз.
Гидроксиды циркония обладают ионообменными свойствами в зависимости от среды – катионообменными или анионообменными, которые усиливаются, если в структуре они содержат анионы многоосновных кислот, в особенности PO4-3. Ионообменники на основе гидроксида циркония имеют более высокую механическую прочность, большую емкость, устойчивость к действию кислот и щелочей, радиации при температурах до 200°С, чем ионообменные смолы.
Цирконаты и гафнаты.
При сплавлении или спекании диоксидов циркония или гафния с гидроксидами или карбонатами щелочных металлов образуются цирконаты или гафнаты общей формулой mM2nZr(Hf)O3, где m=1, n=1-3. Эти соединения медленно гидролизуются водой, а разбавленными кислотами разлагаются полностью. С оксидами щелочеземельных металлов и свинца образуют соединения 1:1 - MIIZr(Hf)O3, которые относятся к группе сложных оксидов. Эти соединения отличает высокая температура плавления и химическая устойчивость. Разлагаются они только кислотами. С оксидами РЗЭ образуются соединения M2IIIZr(Hf)2O7 – большинство этих соединений плавятся конгруэнтно при температуре 2200-2700°С.
При нагревании диоксида циркония или диоксида гафния с оксидами элементов, не являющихся донорами электронов, образуются соединения, в которых цирконий (гафний) и кремний занимают равноценное положение. Например ZrSiO4 (HfSiO4). Основа структуры – кремнекислородные тетраэдры, а плоскоси данную структуру можно изобразить следующей схемой:

Межатомные расстояния Zr (Hf) – O и Si – O близки между собой, поэтому такого типа соединения нельзя рассматривать, как состоящие из ионов Zr4+ и SiO44-.
Такое строение и такой характер связей обуславливают высокую устойчивость и химическую стойкость циркона и гафнона. Диссоциация на диоксид циркония (гафния) и диоксид кремния начинается при температуре 1540°С (заметная летучесть диоксида кремния – при температуре 1900°С). При обычной температуре на циркон не действуют никакие реагенты, только метаморфизированные цирконы растворяются в плавиковой и частично в серной кислотах. В системах состоящих из диоксидов циркония, кремния и оксидов щелочных или щелочеземельных металлов образуются цирконосилликаты различного состава:
В системе ZrO2-SiO2-Na2O три соединения – Na2ZrSi2O7, Na2ZrSiO5 и Na4Zr2Si3O12 плавящихся инконгруэнтно, имеют ионную природу (сложный анион), сравнительно легко разлагаются кислотами.
В системе ZrO2-SiO2-CaO два соединения – Ca3ZrSi2O9, Ca4ZrSi4O12, более устойчивые, плавящиеся конгруэнтно. Разложение кислотами протекает медленнее.
