
- •5. Экспериментальные результаты
- •6. Статистическая обработка результатов анализа
- •7. Вывод
- •Контрольные вопросы и задачи
- •Контрольные вопросы и задачи
- •Гидролизом называется обменная реакция взаимодействия соли с водой, приводящая к смещению равновесия диссоциации воды и, как правило, к изменению кислотности среды.
- •Гидролиз фосфата калия k3po4.
- •Опыт 1. Различные случаи гидролиза солей.
- •Опыт 2. Влияние концентрации раствора на степень гидролиза соли.
- •Опыт 3. Влияние температуры на степень гидролиза соли.
- •Опыт 4. Смещение равновесия гидролиза.
Лабораторная работа 1
ПТБ и оборудование химической лаборатории. Лабораторный журнал
Общие положения
До начала лабораторного занятия студенты должны пройти первичный инструктаж по технике безопасности. Перед выполнением каждой лабораторной работы преподаватель проводит инструктаж на рабочем месте, указывая дополнительные меры предосторожности.
За каждым студентом в учебной лаборатории закрепляется определенное место.
К работе в лаборатории студенты допускаются только в халатах и сменной обуви, при необходимости надеваются очки, респираторы, противогазы, резиновые перчатки, а в некоторых случаях головной убор и прорезиненный фартук.
При подготовке к лабораторной работе студенты обязаны самостоятельно проработать рекомендуемый теоретический материал.
К любой работе можно приступать только в том случае, если все ее этапы понятны и не вызывают сомнений. При возникновении каких-либо неясностей следует немедленно обратиться к преподавателю.
В случае попадания каких-либо химических веществ на тело необходимо быстро промыть участок, на одежду - очистить, промыть и желательно заменить.
Опыты следует проводить с малыми количествами реактивов и строго придерживаться условий, указанных в инструкции.
Любые работы надо выполнять точно, аккуратно, не допуская поспешности и беспорядочности.
На рабочем месте должны находиться только необходимые в данный момент реактивы, приборы и оборудование.
Обо всех неполадках в работе оборудования учебной лаборатории положено немедленно сообщать преподавателю или лаборанту. Категорически запрещены попытки самостоятельного исправления дефектов.
Все приемы оказания первой медицинской (доврачебной) помощи при несчастных случаях напоминаются перед началом лабораторной работы. Каждый должен уметь накладывать повязки для остановки кровотечения, проводить искусственное дыхание, непрямой массаж сердца и т. д. На видном месте должна находиться полностью укомплектованная аптечка первой помощи.
В лаборатории запрещается:
А) работать при неисправной вентиляции;
Б) производить какие-либо работы, не предусмотренные инструкцией;
В) принимать пищу или питье;
Г) работать без спецодежды;
Д) шуметь, громко разговаривать, производить резкие движения;
Е) хранить личную одежду;
Ж) работать в лаборатории одному;
З) оставлять без присмотра работающие установки, нестационарные нагревательные приборы, открытое пламя.
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ ПРОВЕДЕНИИ ЛАБОРАТОРНЫХ РАБОТ
Работа с реактивами
Насыпать или наливать реактивы разрешается только над столом.
Реактивы следует после использования плотно укупоривать, а наиболее летучие помещать в вытяжной шкаф.
Все работы с пылящими, летучими и концентрированными реактивами следует проводить только в вытяжном шкафу при включенной вентиляции.
При работе с агрессивными жидкостями следует пользоваться подносами с бортиками.
Просыпанные или пролитые реактивы следует немедленно и тщательно убирать.
Категорически запрещается выбрасывать в раковины не смешивающиеся с водой жидкости и твердые вещества, а также опасные токсичные вещества.
Категорически запрещается пользоваться реактивами без этикеток или с сомнительными этикетками, путать пробки склянок во избежание загрязнения реактивов.
Запрещается превышать нормы расхода реактивов, указанные в инструкции; ссыпать или сливать ошибочно взятый избыток реактива обратно в исходную емкость.
Запрещается вносить или выносить реактивы без разрешения преподавателя или лаборанта.
Запрещается нарушать правила разбавления растворов: вещества вливаются в воду!
Запрещается нарушать правила определения запахов: только с помощью ладони!
Работа с огнеопасными веществами
Нельзя допускать попадания горючих паров в атмосферу - работать только в вытяжном шкафу.
Категорически запрещается работать с огнеопасными веществами вблизи включенных горелок или электрических приборов.
Лаборатория должна быть снабжена средствами для тушения пожаров в соответствии с существующими нормами. Обязательно наличие сухого песка, асбестового одеяла, пенного (ОП-5) и углекислотного (ОУ-5) огнетушителей.
Работа со стеклом
Применение физической силы при работе со стеклянными приборами и оборудованием не допускается.
Категорически запрещается использовать посуду, имеющую трещины.
Категорически запрещается разламывать трубки или вскрывать ампулы по месту надпила, не обернув их при этом полотенцем.
Осколки разбитой посуды убирать немедленно с помощью щетки и совка.
Нагревание производить только в посуде из термостойкого стекла. Следует учитывать маркировку стекла: ХС - химически стойкая посуда для кислот и щелочей; ТС - термостойкая посуда; ХТС - химическая термостойкая посуда.
Сборку лабораторных установок со стеклянными деталями производить осторожно, аккуратно, согласно инструкции, без нажима, смазывая концы трубок вазелином или глицерином, нажимая с поворотом по спирали, обернув стекло полотенцем.
Категорически запрещается использование для работы грязной посуды и оборудования. Для мытья посуды после опытов следует применять хозяйственное мыло, кальцинированную соду. Мытье производить в резиновых перчатках.
ОБРАЩЕНИЕ С НАГРЕВАТЕЛЬНЫМИ ПРИБОРАМИ
Зажигать спиртовку или газовую горелку только спичкой! Запрещается наклоняться над горящим прибором!
Запрещается наливать в пробирку для нагревания более 1/3 объема пробирки.
Запрещается нагревание сосуда на границе жидкости или выше ее!
Запрещается наклоняться к отверстию нагреваемого сосуда и направлять отверстие сосуда в сторону соседей.
Нагревание следует начинать с прогрева всего объема жидкости слабым пламенем, затем греть до нужной температуры.
Запрещается оставлять работающие нагревательные приборы без присмотра.
При переноске нагретых веществ или посуды следует пользоваться специальными щипцами, рукавицами. Тяжелые сосуды переносят, обернув полотенцем и держа двумя руками: под дно и у верха сосуда.
РАБОТА С ЭЛЕКТРИЧЕСКИМ ТОКОМ
Визуально проверить наличие заземления, на ощупь убедиться в плотности контакта токоподводящего провода с электрооборудованием.
При работе с электрооборудованием необходимо: а) работать только на исправном оборудовании, б) не включать и не выключать приборы мокрыми руками, в) не переносить и не ремонтировать включенные приборы, г) при отключении подачи тока все оборудование должно быть немедленно выключено.
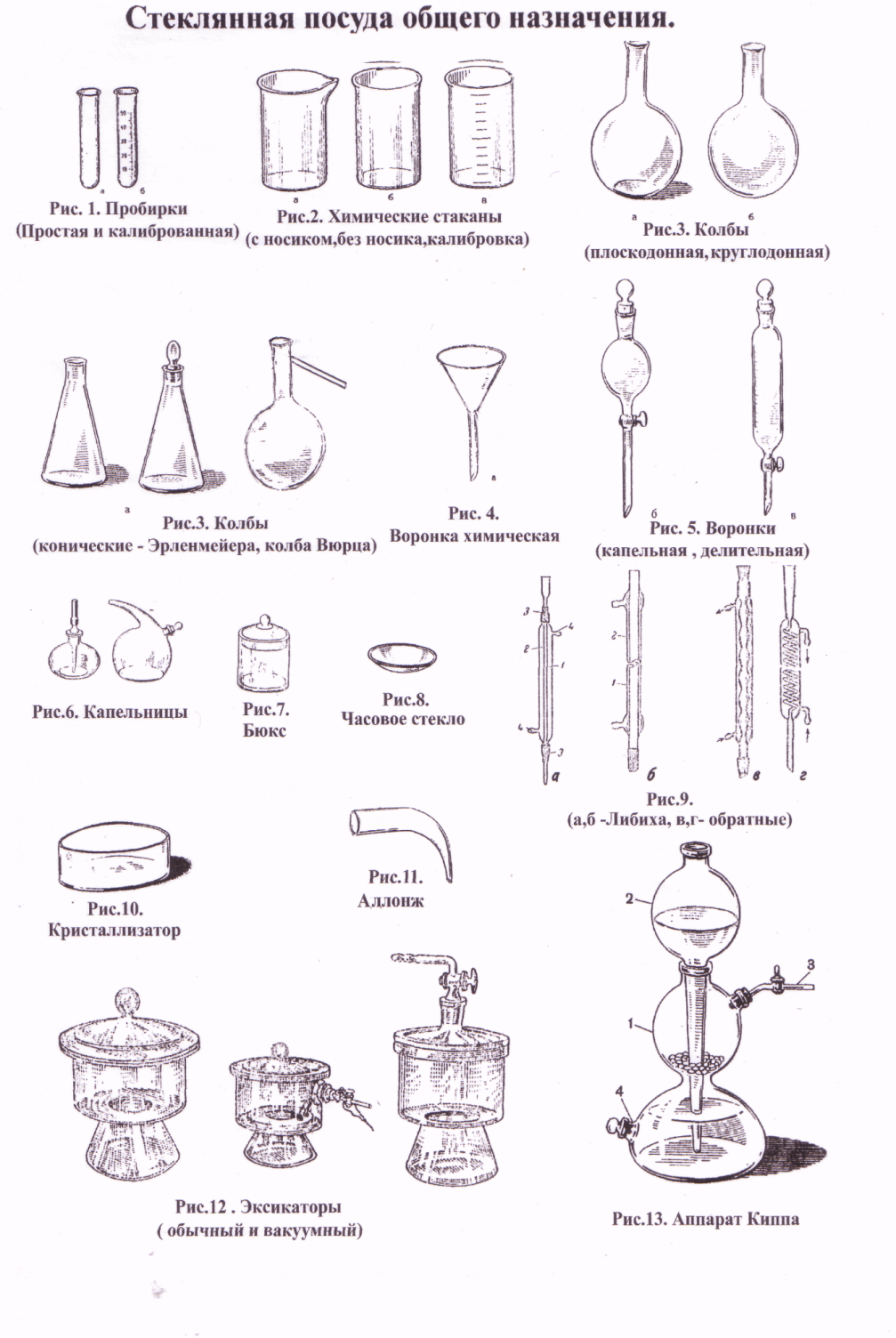
Химическая посуда, лабораторное оборудование и химические реактивы. Химическая посуда.
Стеклянная посуда общего назначения.
Основным требованием, предъявляемым к стеклянной посуде, является ее химическая и термическая устойчивость. Химическая устойчивость – это свойство стекла противостоять разрушающему действию растворов щелочей, кислот и других веществ. Термическая устойчивость – способность посуды выдерживать резкие колебания температуры.
Лучшим стеклом для изготовления лабораторной посуды считается пирекс. Этот тип стекла обладает термической и химической устойчивостью, имеет малый коэффициент термического расширения. Пирексное стекло содержит 80% оксида кремния (IV). Температура размягчения его около +6200С. Для проведения опытов при высоких температурах используют посуду изкварцевого стекла. Кварцевое стекло содержит 99,95% оксида кремния (IV), температура размягчения его +16500С. Лабораторную посуду изготавливают в основном из стекла типов ТУ (термически устойчивое), ХУ-1 и ХУ-2 (химически устойчивое). Содержание оксида кремния (IV) в обычном лабораторном стекле составляет 70%. В лабораторной практике наибольшее распространение получили следующие виды стеклянной посуды:
Пробирки простые и калиброванные (с делениями, указывающими объем) (рис. 1) используют для проведения опытов с небольшим количеством реактивов. Объем реактива в пробирке не должен превышать половины ее объема. Лабораторные стаканы (рис. 2) выпускают различных размеров, с носиком и без носика, простые и калиброванные. Стаканы предназначены для выполнения самых разнообразных процедур.
Колбы различного размера и формы (круглые, конические, плоскодонные, круглодонные (рис. 3). Например, в лабораторной практике широко применяют конические плоскодонные колбы(колбы Эрленмейера). Колба Вюрца представляет собой круглодонную колбу с отводной трубкой под углом 60-800. Ее используют для получения газов и для отгонки жидкостей при атмосферном давлении.
Воронки химические (рис. 4) служат для переливания жидкостей и фильтрования; капельные воронки (рис. 5) используют для введения в реакционную среду жидких реактивов небольшими порциями. Воронки делительные (рис. 5) применяют для разделения несмешивающихся жидкостей. Капельницы (рис. 6) используют для введения реактивов малыми порциями, по каплям.
Бюксы (рис. 7) предназначены для взвешивания и хранения жидких и твердых веществ.
Часовые стекла (рис. 8) используют для проведения реакций в малых объемах (капельные реакции) и для взвешивания твердых веществ. Холодильники (рис. 9) применяются для охлаждения и конденсации паров, образующихся при нагревании различных веществ. При перегонке применяют прямые холодильники (Либиха), а при кипячении растворов и жидкостей, экстракции и других подобных процессах используют обратные холодильники. Кристаллизаторы (рис. 10) применяют для получения кристаллов веществ из насыщенных растворов или для охлаждения химических стаканов или колб с реагирующими веществами.
Аллонжи (рис. 11) играют роль соединительных элементов в установках по пергонке веществ.
Эксикаторы (рис. 12) применяют для медленного высушивания и хранения веществ, легко поглощающих влагу из воздуха. Нижнюю часть эксикатора заполняют водопоглощающими веществами (прокаленный хлорид кальция, концентрированная серная кислота, оксид фосфора (V) и др.). Над поглотителем на фарфоровом вкладыше помещают бюксы или тигли с веществами, подлежащими осушке. Различают два основных типа эксикаторов: обычные эксикаторы и вакуум-эксикаторы. Аппарат Киппа (рис. 13) – прибор для периодического получения водорода, сероводорода, оксида углерода (IV) и других газов в лаборатории. Фарфоровая посуда
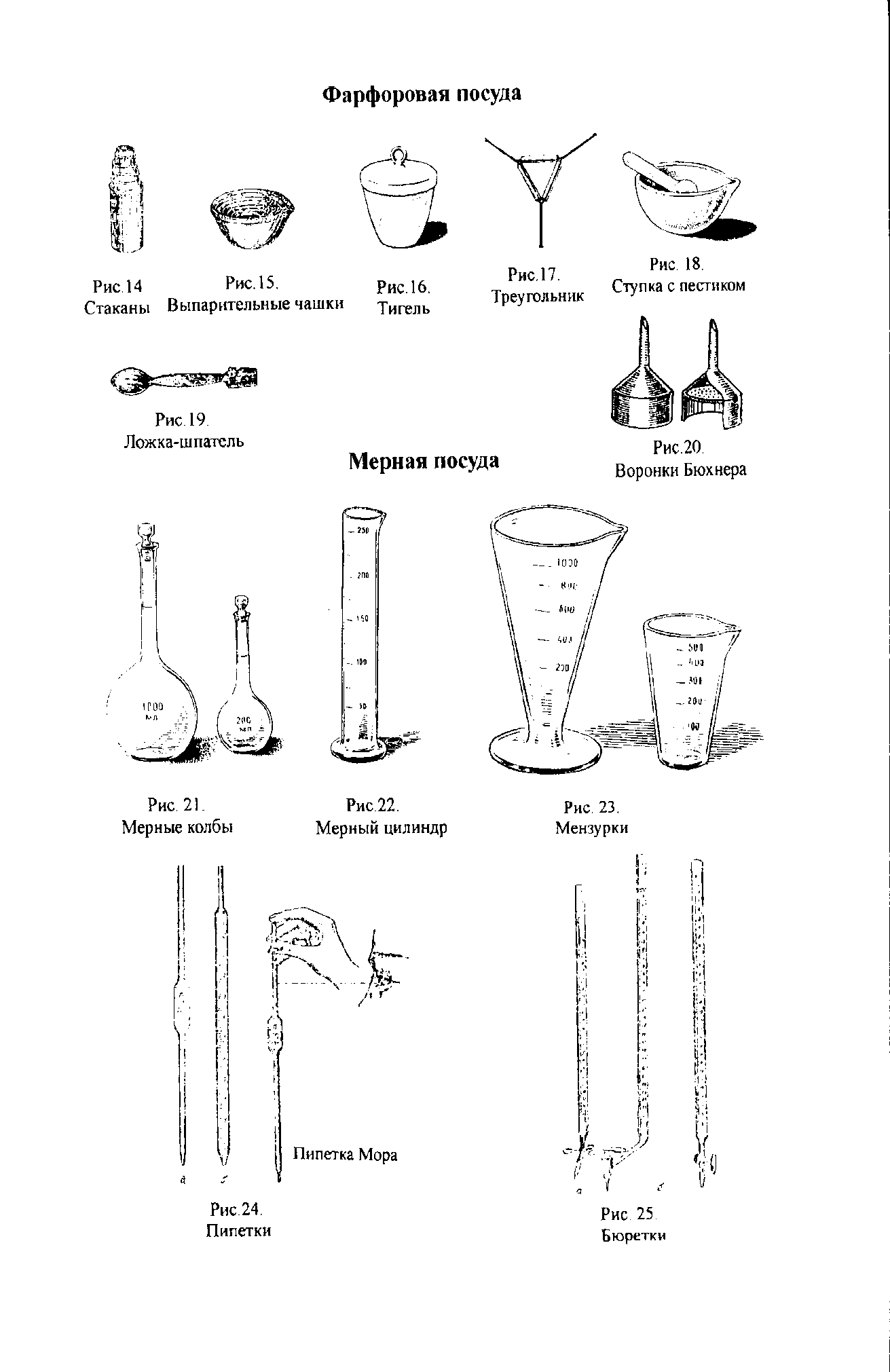
По сравнению со стеклянной обладает большей химической устойчивостью к кислотам и щелочам, большей термостойкостью. Фарфоровые изделия можно нагревать до температуры около 12000С. Недостатком ее является непрозрачность и сравнительно большая масса. Фарфоровая посуда также разнообразна по форме и назначению. Стаканы (рис. 14) бывают различной емкости, с ручкой и без ручки, с носиком и без носика.
Фарфоровые кружки так же бывают различной емкости (обычно от 250 мл до 2-х литров.)
Выпарительные чашки (рис. 15) используют для выпаривания и нагревания жидкостей. Тигли (рис. 16) – сосуды, применяемые для прокаливания различных твердых веществ (осадков, минералов и т.п.), а также для сплавления и сжигания. При прокаливании веществ на пламени газовой горелки тигли закрепляют в проволочных треугольниках с фарфоровыми трубками (рис. 17). Фарфоровые ступки с пестиком (рис. 18) применяют для измельчения твердых веществ. Перед работой ступка должна быть тщательно вымыта и высушена. Вещество насыпают в ступку в количестве не более 1/3 ее объема (иначе оно будет высыпаться из ступки при измельчении). При растворении твердого вещества в ступке (с одновременным растиранием) вначале насыпают твердое вещество, а затем к нему постепенно небольшими порциями при круговом движении пестика добавляют жидкость. Всю жидкость, которую берут для растворения, употреблять не следует: не менее 1/3 количества ее оставляют для того, чтобы по окончании растворения сполоснуть ступку и обмыть пестик, после чего этот раствор добавляют к ранее полученному раствору. Фарфоровые ложки-шпатели (рис. 19) применяют для отбора веществ, для снятия осадков с фильтров и при многих других работах.
Воронки Бюхнера и фарфоровые сетки (рис. 20) применяют для фильтрования жидкостей при пониженном давлении (под вакуумом). Мерная посуда.
Для измерения объемов жидкостей используют разнообразную мерную посуду: мерные колбы, мерные цилиндры, мензурки, пипетки и др.
Мерные колбы (рис. 21) служат для приготовления растворов точной концентрации и представляют собой круглые плоскодонные колбы с длинным и узким горлом, на котором нанесена тонкая черта. Эта отметка показывает границу, до которой следует наливать жидкость, чтобы ее объем соответствовал указанному на колбе значению. Цифры на колбе показывают объем жидкости (мл), на который она рассчитана. Мерные колбы обычно имеют притертые пробки. Применяют колбы на 50,100, 250, 500 и 1000 мл. Мерные колбы меньшего объема, использующиеся для определения плотности жидкостей, называются пикнометрами.
Мерные цилиндры (рис. 22) представляют собой стеклянные сосуды, которые для большей устойчивости имеют широкое основание (дно) или специальную подставку. Снаружи на стенках цилиндров нанесены деления, указывающие объем (в мл). Мерные цилиндры бывают различной емкости: от 5 мл до 2 л. Их назначение – измерять (с определенной погрешностью) различные объемы жидкости.
Мензурки (рис. 23)-это сосуды конической формы с делениями на стенке. Пипетки (рис. 24) служат для отбора точно определенных относительно небольших объемов жидкостей. Они представляют собой стеклянные трубки небольшого диаметра с делениями. Некоторые пипетки имеют расширение посредине (пипетки Мора). Нижний конец пипетки слегка оттянут и имеет внутренний диаметр до 1 мм. На верхнем конце пипетки имеется метка, до которой набирают жидкость. Некоторые пипетки снабжены двумя метками. Обычно пипетки имеют емкость от 1 до 100 мл.
Бюретки (рис. 25) служат для отмеривания точных объемов жидкостей, преимущественно при химико-аналитических работах (титрование). Они могут иметь различную конструкцию и иметь разный объем. Пластмассовая посуда.
В лабораторной практике используют посуду, изготовленную из полимерных материалов (полиэтилен, полипропилен, фторопласт и др.) При высокой химической устойчивости такая посуда обладает низкой термостойкостью, и поэтому ее обычно используют в работах, не требующих нагревания. Из полиэтилена изготовляют воронки для жидких и сыпучих веществ, промывалки, капельницы, флаконы и банки для транспортировки и хранения химических реактивов, пробирки для центрифугирования, пипет-дозаторы и наконечники к ним и др.
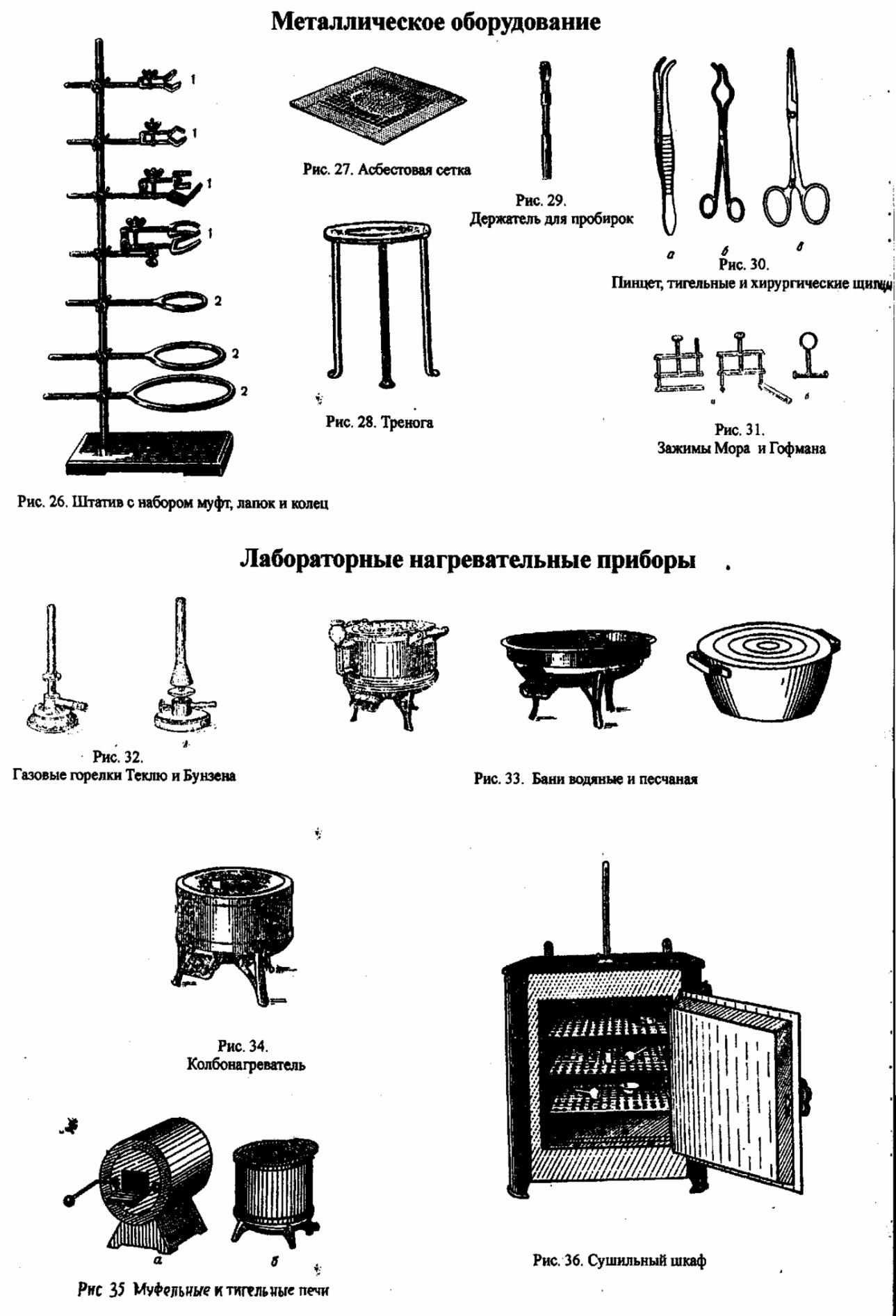
Металлическое оборудование.
В химических лабораториях широко применяют разнообразное металлическое оборудование, преимущественно стальное.
Штативы (рис. 26) с набором муфт, лапок и колец используют для закрепления на них во время работы различных приборов, стеклянной посуды (холодильников, колб, делительных воронок и пр.). Кольца, закрепленные на штативе, используют также при нагревании химической посуды на металлических асбестированных сетках (рис. 27) газовыми горелками. Треноги (рис. 28) применяют в качестве подставок для различных приборов, колб и пр. Они особенно удобны при нагревании крупных по размеру колб и громоздких приборов.
Держатели для пробирок (рис. 29) – приспособления, которые используются при непродолжительном нагревании пробирок.
Пинцеты (рис. 30) – приспособления для захватывания мелких предметов, а также веществ, которые нельзя брать руками, например, металлический натрий.
Тигельные щипцы (рис. 30) применяют для захватывания горячих тиглей при извлечении их из муфельной печи, снятия раскаленных тиглей с фарфоровых треугольников и при всех работах, когда приходится иметь дело с раскаленными предметами.
Зажимы (рис. 31) – приспособления, используемые для зажимания резиновых трубок. Обычно применяют пружинные зажимы (зажимы Мора) и винтовые (зажимы Гофмана). Последниепозволяют легко регулировать скорость вытекания жидкости или интенсивность прохождения газов. Лабораторные нагревательные приборы.
В лаборатории применяют различные нагревательные приборы: газовые горелки, электрические плитки, бани, сушильные шкафы, муфельные печи и т. п. Бани (рис.33). Для продолжительного нагревания в пределах температуры 100-3000С применяют бани: водяную, песчаную и др. Они представляют собой, как правило, металлические чаши, заполненные водой (водяная баня) или сухим, чистым песком, прокаленным для удаления из него органических примесей (песчаная баня). Нагревание бань проводят пламенем газовой горелки. Используются также водяные и песчаные бани с электрообогревом. Электрические плитки. В тех случаях, когда требуется нагревание, а пользоваться горелками нельзя (например, при перегонке воспламеняющихся легколетучих жидкостей) применяют электрические плитки.
Для нагревания круглодонной стеклянной посуды применяют колбонагреватели (рис.34). Печи. Для получения температуры 600-14000С применяются электрические муфельные печи (рис.35). С помощью особого регулировочного устройства печь может нагреваться до определенной, заранее заданной температуры. Сушильные шкафы (рис.36) имеют электрический обогрев и терморегулятор, позволяющий поддерживать постоянную температуру. Для наблюдения за температурой шкаф снабжен термометром. Высушиваемое вещество помещается в сушильный шкаф, отрегулированный на требуемую температуру, и выдерживается в нем при заданной температуре определенное время. В работах количественного характера сушку проводят несколько раз до достижения высушиваемым веществом постоянной массы.
Химические реактивы и их хранение
Химические реактивы представляют собой индивидуальные вещества, их растворы или смеси строго регламентированного состава. Химические реактивы предназначаются для практического применения, например, лабораторных работ, научных исследований, химического анализа и др. Они могут использоваться в твердом, жидком или газообразном состояниях (в виде паров). Их принято разделять по степени чистоты на несколько квалификаций, характеристики которых приведены в таблице.
Твердые реактивы хранят в стеклянных и полиэтиленовых банках, а жидкие - в склянках. В зависимости от свойств веществ банки и склянки закрывают стеклянными, полиэтиленовыми, резиновыми или корковыми пробками. Гигроскопичные вещества хранят в бюксах, эксикаторах, запаянных ампулах, склянках с хлоркальциевыми трубками и банках с притертыми пробками. Пробки банок можно заливать парафином. Реактивы, изменяющиеся под действием света, хранят только в темных склянках. Газообразные химические реактивы в больших количествах хранят в баллонах, а в небольших - в газовых бюретках и газометрах.
Для рабочего лабораторного журнала необходимо взять общую тетрадь, в которой сразу же пронумеровать страницы.
На титульном листе должны содержаться:
– надпись«лабораторный журнал по»;
– название курса;
– Фамилия И.О. студента;
– номер группы;
– название факультета.
В дальнейшем, указанные данные, при необходимости, могут быть дополнены (например, при переходе от курса «Количественныйанализ» к курсу «Физико-химические методы анализа»).
Первые два листаследует оставить для оглавления, которое составляют по ходу работы.
Все записи при выполнении лабораторной работы должны вестись исключительно в лабораторном журнале ручкой; при этом необходимо стремиться к сочетанию краткости записей с их исчерпывающей полнотой.Категорически запрещается делать записи на отдельных листках бумаги! Лабораторный журнал является одновременно и черновиком, и чистовиком. Его следует вести самым аккуратным образом. Здесь и только здесь производятся все записи при выполнении лабораторной работы, в том числе прикидочныерасчеты и предварительные результаты. Наличие таких записей позволяет в любой момент проверить правильность выполнения расчетов или выявить источник ошибки при выполнении лабораторной работы.
Нельзя ничего стирать и исправлять в журнале: в случае ошибки цифру или слово следует зачеркнуть, проставивисправленное над зачеркнутым или рядом с ним. Все исправления в журнале должны делаться так, чтобы предыдущий результат оставался читаемым. Рядом с исправлением следует указывать, в чем состоит причина исправления ("неправильный расчет", "повторный результат" и т.д.). Если неправильным оказался большой материал, не надо вырывать страницы из журнала: достаточно перечеркнуть их по диагонали, указав причину вычеркивания.
В случае отсутствия лабораторного журнала, преподаватель ставится в известность в начале занятия, подписывается у негоотдельный листок, который в последующем, со всеми полученными данными, вклеивается в лабораторный журнал.
Если для записи результатов анализа или оформления отчета недостаточно предварительно отведенного места в журнале, то в конце записи ставится ссылка с указанием страницы с продолжением записи.
Для ведения черновых записей рекомендуется использовать левые страницы журнала, для оформления отчета и чистовых записей – правые.
Отчет по лабораторной работе оформляется в лабораторном журнале и должен состоять из следующих разделов:
1. Дата выполнения и название лабораторной работы.
2. Цель работы.
3. Краткое теоретическое введение:
– уравнения химических реакций.
– кривая титрования (схематично, в общем виде)
– закон эквивалентов
– расчетные формулы результата анализа
– предварительные расчеты, необходимые для выполнения работы (например, расчет массы навески, объема титранта и т.п.).
– краткое описание свойств веществ, используемых в работе, и обоснование их выбора для выполняемого анализа.
4. Оборудование и реактивы.
§ Приводятся названия и характеристики использованных в работе приборов, стеклянной посуды и реактивов.
§ Для всех средств измерений (мерные колбы, пипетки, бюретки, весы, растворы точной концентрации) приводятся метрологические характеристики согласно их маркировке или справочным данным.
§ Для веществ, используемых в качестве стандарта, приводится степень чистоты или характеристика, ее заменяющая.
§ Если в качестве титранта или вторичного стандарта используется собственный раствор, полученный и стандартизованный в рамках другой лабораторной работы, то приводится ссылка на соответствующую страницу журнала.
§ Для оборудования, посуды и реактивов, используемых в качестве вспомогательных, достаточно общего описания (для растворов – номинальных концентраций).
5. Экспериментальные результаты
§ Результаты работы оформляются, как правило, в виде таблиц, содержащих исходные данные и результаты вычислений, каждая таблица должна иметь название. Экспериментальные данные последовательно заносятся в соответствующие столбцы таблицы; в верхней части столбца обязательно указывается наименование и единица измерения приведенной величины. Каждое число в таблице должно содержать не больше и не меньше значащих цифр, чем позволяет точность экспериментальных данных.
§ Приводятся все расчетные формулы (без вывода) как в символьном виде, так и с подставленными числами и рассчитываются результаты определения.
§ Если в работе используется несколько вариантов выражения исходной величины (например, концентрация, титр, условный титр), то результат анализа (например, массу) следует рассчитать по каждой из них.
6. Статистическая обработка результатов анализа
В этом разделе приводится обоснование выбраковки отдельных результатов анализа, являющихся грубыми ошибками (достаточно расчетов по Q-критерию). А также приводятся формулы (без вывода) и результаты расчета погрешности анализа.
Рассчитать:
– значение Q-критерия для максимального и минимального значений результатов измерения
– среднее значение результата анализа
– стандартное отклонение выборки
– коэффициент вариации выборки (относительное стандартное отклонение)
– стандартное отклонение среднего значения
– доверительный интервал среднего значения (для доверительной вероятности P=95%)
– относительную погрешность результата анализа.
– если в работе необходим расчет нескольких величин (титры, концентрации), то для каждой из них приводится доверительный интервал, рассчитанный из доверительного интервала или относительной погрешности непосредственно измеряемой величины.
7. Вывод
Вывод формулируется, исходя из цели работы, и содержит в себе результат анализа вместе с его абсолютной погрешностью, выраженной доверительным интервалом. В доверительном интервале достоверной является лишь одна значащая цифра (если эта цифра 1, то приводится две значащие цифры). Среднее значение измеряемой величины округляется до разряда, оставшегося в абсолютной погрешности после округления. Например, при определении концентрации серной кислоты вы получили среднее значение молярной концентрации 0.101235 моль/л и доверительный интервал (n=5, p=95%) 0.000855 моль/л. Конечный результат следует записать 0.1012±0.0009 моль/л.
Разделы 1-3 отчёта оформляются перед лабораторной работой, разделы 4-7 оформляются непосредственно на лабораторной работе. Отчет по лабораторной работе сдается преподавателю на проверку не позже, чем через неделю после выполнения работы.
Лабораторная работа 2
Определение теплоты реакции нейтрализации
ЦЕЛЬ РАБОТЫ
Освоить методику определения тепловых эффектов процессов.
Определить тепловой эффект при нейтрализации кислоты щелочью.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Тепловой эффект химической реакции
Как известно, каждое физико-химическое превращение вещества сопровождается превращением энергии. Для сопоставления изменения энергии при различных реакциях в термодинамике используются понятие теплового эффекта, т. е. количества теплоты, которое выделяется или поглощается в химическом процессе при условии равенства начальной и конечной температуры. Тепловой эффект обычно относят к молю реагирующего вещества и выражают в джоулях.
Тепловые эффекты отличаются друг от друга, если процессы происходят в закрытом сосуде (при постоянном объеме V=const) или в открытом сосуде (при постоянном давлении P=const).
Тепловой эффект при постоянном объеме равен убыли внутренней энергии: QVT= –∆UT, а при постоянном давлении – убыли энтальпии:
QРT= –∆НT
Тепловой эффект не зависит от промежуточных стадий, а определяется лишь начальным и конечным состоянием системы при условии, что единственной работой, совершаемой системой, является работа против внешнего давления и что давление или объем в течении всего процесса остаются неизменными (закон Гесса). С помощью закона Гесса производят различные термохимические расчеты.
Тепловой эффект реакции нейтрализации
Согласно учению о водных растворах электролитов процесс нейтрализации сильной кислоты сильным основанием сводится к соединению ионов водорода с ионами гидроксида:
H++A−+Me++OH−→H2O+Me++A−
или:
H++OH−→H2O
Поэтому теплота нейтрализации эквивалентных количеств сильных кислот и основание при достаточном разбавлении одна и та же и равна
–57,22 кДж/моль.
Если при нейтрализации кислота или основание (или оба компонента) являются слабыми электролитами, то в этом случае протекают два процесса: процесс диссоциации слабого электролита и процесс нейтрализации:
HA↔H++A−+∆HДИСС.
(НА – слабый электролит)
Н++ОН−→Н2О+∆ННЕЙТР.
Суммируя уравнения (1) и (2) получим,
НА+ОН−↔А−+Н2О+∆НХ
Следовательно:
∆НХ=∆НДИСС.+∆ННЕЙТР. (1)
Определив экспериментально ∆НХ и зная ∆ННЕЙТР., можно на основании уравнения (1) рассчитать ∆НДИСС.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Описание установки
Определение тепловых эффектов производят в специальных приборах, называемых калориметрами. В зависимости от характера процесса и реагирующих веществ применяют калориметры различных конструкций, но все калориметры содержат калориметрический сосуд, который защищается от потерь тепла и снабжен чувствительным ртутным тепломером или другим устройством для измерения температуры.
Для определения теплот реакций, протекающих в водных растворах, можно использовать калориметрическую установку, изображенную на рис.1.

Рис. 1. Схема калориметрической установки:
1 – наружный стакан; 2 – реакционный стакан; 3 – подставка; 4 – крышка; 5 – мешалка; 6 – термометр; 7 – воронка.
В стеклянный стакан (1) емкостью 0,5л, вставляют другой стакан (2) емкостью 0,3л. Стаканы между собой не должны соприкасаться во избежание потерь теплоты через стенки внутреннего калориметрического сосуда, для чего между ними помещают корковые прокладки. Внутренний стакан закрыт крышкой (4) с тремя отверстиями для проволочной мешалки (5), термометра (6) с ценной деления 0,10С и воронки (7) для смывания в калориметр вещества или наливания раствора.
Выполнение эксперимента и обработка результатов
Теплоту нейтрализации (∆ННЕЙТР) и теплоту диссоциации слабого электролита (∆НДИСС) определяют, проводя в калориметре поочередно две из следующих реакций:
I. 1) КOH+HNO3 2) NH4OH+HNO3 слабое осн. |
IV. 1) KOH+HCl 2) KOH+CH3COOH слабая кислота |
II. 1) NaOH+HNO3 2) NaOH+CH3COOH слабая кислота |
V. 1) NaOH+HCl 2) NaOH+CH3COOH слабая кислота |
III. 1) NaOH+HCl 2) NH4OH+HCl слабое осн. |
VI. 1) КOH+HNO3 2) NaOH+CH3COOH слабая кислота |
Во внутренний стакан калориметра налейте 50 – 100 мл 2н. раствора щелочи, поставьте стакан в калориметр и измерьте температуру раствора с точностью до 0,10С.
В другой стакан налейте 50мл 2н. раствора кислоты и также измерьте его температуру.
Определите начальную температуру tН как среднее арифметическое из температур растворов щелочи и кислоты.
При перемешивании через воронку быстро влейте раствор кислоты в калориметр. При этом следите за изменением температуры и отметьте самую высокую температуру tК.
Аналогично проведите в калориметре реакцию с участием любого электролита, проделав те же измерения и расчеты.
Результаты опытов оформите в виде таблицы.
Таблица.
№ п/п |
Реагенты |
tщел, 0С |
tкисл, 0С |
tн, 0С |
tк, 0С |
∆t, 0С |
c1, Дж/г·К |
m1, г |
c2, Дж/г·К |
m2, г |
∑ci·mi, Дж/К |
Q, кДж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Количество теплоты, выделяющейся или поглощающейся в калориметре, определяется по формуле:
Q=(tK-tH)·∑C; (2)
где tK– конечная температура;
tH– начальная температура;
∑C – теплоемкость системы, слагающая из теплоемкостей калориметрического сосуда и находящегося в нем вещества.
Теплоемкость системы равна
∑C=c1m1+c2m2, (3)
где с1 и m1 – удельная теплоемкость и масса реакционного сосуда;
с2 и m2 – те же величины для жидкости, находящейся в калориметре.
Для расчета теплоемкости системы по формуле (3) используйте следующие данные:
− теплоемкость стекла с1=0,753Дж/г·К;
− теплоемкость раствора (воды) с2=4,186Дж/г·К;
− плотность раствора (воды) ρ=1г/мл, Vр-ра=Vк-ты+Vщел.
Рассчитайте количество теплоты, выделившейся в калориметре, по формуле (2).
Используя значения Q, полученные в 1-ом и 2-ом опытах, рассчитайте тепловые эффекты реакций на 1 моль вещества:
Для I реакции:
 ,
где γ=Сн∙V.
,
где γ=Сн∙V.
[кДж/моль]
Вычислите относительную ошибку опыта:
 ;
ΔН0нейтр.
теор.=
– 57,22 кДж/моль.
;
ΔН0нейтр.
теор.=
– 57,22 кДж/моль.
Для II реакции:
 .
.
Вычислите ΔН0диссоц. слабого электролита
Оформление отчета
1. Таблица результатов.
2. Под таблицей представить расчеты:
Для I реакции: молекулярное и ионно-молекулярное уравнение
а) Расчет Q нейтрализации.
б)
Расчет

в) Расчет относительной ошибки.
Для II реакции: молекулярное и ионно-молекулярное уравнение
а) Расчет Q нейтрализации.
б) Расчет .
в) Расчет ΔН0диссоц. слабого электролита.
Контрольные вопросы и задачи
Что такое тепловой эффект реакции? При каких условиях тепловой эффект химической реакции численно равен изменению энтальпии?
Почему энтальпия нейтрализации сильных кислот и оснований одинакова для различных кислот и оснований, а энтальпия нейтрализации слабых кислот и оснований зависит от природы реагирующих веществ?
Что называется стандартной энтальпией (теплотой) образования соединения? Для какого вещества стандартная энтальпия образования равна нулю:
а) Н2О2; б) Н2SO4; в) О2; г) СаСО3; д) О3.
4. Укажите уравгнение реакции, ΔН0 которой является энтальпией образования соединения:
а) СаО(кр) + СО2(г) = СаСО3(кр);
б) С(кр) + 2Сl2(г) = ССl4(г);
в) СF4(г) = С(кр) + 2F2(г);
г) Сu2S(кр) + 2О2(г) = 2СuО(кр) + SO2(г).
5. При разложении 0,5 моль СО2 на простые вещества поглощается 196,7 кДж теплоты. Определите энтальпию образования СО2 (кДж/моль).
6. Вычислите стандартные изменения энтальпии в реакциях:
а) 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(ж);
б) Fe2О3(кр) + 3СО(г) = 2Fe(кр) + 3СО2(г);
в) 3СН4(г) + СО2(г) + 2Н2О(ж) = 4СО(г) + 8Н2(г).
Лабораторная работа 3
Колориметрическое определение реакции среды
Теоретическая часть
Основные понятия
Дистиллированная вода в очень небольшой степени проводит электрический ток. Вода является слабым электролитом, ее молекулы диссоциируют на ионы. Электролитическая диссоциация воды:
H2O ↔ H+ + OH¯
2H2O ↔ H3O+ + OH¯
По закону действующих масс к обратному процессу диссоциации, можно записать выражение константы диссоциации воды. По величине электропроводности воды известна степень диссоциации воды, концентрация ионов H+ и OH¯, а также значение константы диссоциации:

Так как степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул [H2O] можно считать постоянной и равной 55,56 моль.
Кдис[H2O] = [H+] [OH¯]=1.8*10-16*55.56
[H+] [OH¯]=1*10-14
Ионное произведение воды
Кводы = [H+] [OH¯]=1*10-14
При
диссоциации молекулы воды получается
один ион H+
и один ион OH¯,
поэтому концентрации обоих ионов будут
равны 10-7
моль/л: [H+]=[OH¯]= моль/л
моль/л
Растворы, в которых концентрация ионов H+ равна концентрации ионов OH¯, называются нейтральными растворами.
Растворы, в которых концентрация ионов H+ больше концентрации ионов OH¯, являются кислыми растворами.
[H+]>[OH¯]>10-7
Растворы, в которых концентрация ионов H+ меньше концентрации ионов OH¯, являются щелочными растворами.
[H+]<[OH¯]<10-7
Следовательно, концентрация ионов водорода выступает в качестве характеристики среды.
а) Если [H+]=[OH¯]=10-7 моль/л – среда нейтральная
б) Если [H+]>[OH¯]>10-7 моль/л (например 10-4) – среда кислая
в) Если [H+]<[OH¯]<10-7 моль/л (например 10-12) – среда щелочная
Так как степенные выражения концентрации ионов H+ неудобны то их заменили логарифмическими функциями. Вместо концентрации ионов водорода для характеристики кислотности среды используют десятичный логарифм концентрации ионов H+, взятый с обратным знаком. Эту величина называется водородным показателем и её обозначают pH:
рH = - lg [H+]
а) Среда нейтральная
рН = -lg 10-7 = 7
б) Среда кислая
рН <7, например рН = -lg10-4 = 4
в) Среда щелочная
рН >7, например рН =-lg10-12 = 12
[H+] |
1,0 |
10-3 |
10-4 |
10-6 |
10-7 |
10-8 |
10-9 |
10-10 |
10-11 |
10-14 |
рН |
0 |
3 |
4 |
6 |
7 |
8 |
9 |
10 |
11 |
14 |
Характер раствора (среды) |
Кислый |
Слабо - кислый |
Нейтраль-ный |
Основной |
Щелочной |
|||||
14 < рН< 0
рН + рОН = 14
В качестве индикаторов используют органические вещества, изменяющие свою окраску в зависимости от концентрации ионов водорода в растворе. Для каждого индикатора имеется свой интервал значений рН, при котором изменяется его окраска. Наиболее распространены индикаторы: лакмус, фенолфталеин, метилоранж.
Практическая часть
Опыт №1. Окраска кислотно-щелочных индикаторов в кислой и щелочной среде
Пронумеровать 6 пробирок, в первые три налить по 1-2 мл 0,1 н. раствора HCl, в три другие налить по 1-2 мл 0,1М раствора KOH. Поместить пробирки в штатив и добавить в каждую по одной капле индикаторов. Отметить окраску взятых веществ в сильнокислой и сильнощелочной среде. Рассчитать значения рН в этих растворах. Записать результаты в таблицу.
HCl 0,1 н.=0,1 М

f=0,86
[H+]=0,086=8,6*10-2
pH= -lg[H+]=1,06
NaCl 0,1 М
f=0,81
[OH-]=0,081
[H+]=10-14/8,1*10-2=1,2*10-12
pH= -lg[H+]=11,9
Номер пары пробирок |
Индикатор |
Наблюдаемая окраска |
|
В сильнокислой среде рН=1,06 |
В сильнощелочной среде рН=11,9 |
||
1 и 1а |
Фенолфталеин |
Бесцветный |
Малиновый |
2 и 2а |
Лакмус |
Розовый |
Синий |
3 и 3а |
Метилоранж |
Красный |
Желтый |
В результате проведения опыта мы выяснили, что для выявления нейтральной среды следует пользоваться метилоранжем или лакмусом, для щелочной фенолфталеином, для кислой метилоранжем или лакмусом.
Опыт №2 Определение рН раствора при помощи индикаторов
Получили у преподавателя раствор, у которого необходимо определить значение рН. В 3 пробирки налили 1-2 мл раствора и добавили по 1-2 капли каждого индикатора. Отметили цвет раствора в каждой пробирке. Сопоставили данные с таблицей и установили порядок величины рН в исследуемом растворе.
X + фенолфталеин = раствор помутнел
Х + метилоранж = оранжевый
Х + лакмус = фиолетовый
Из таблицы следует что значение рН находится в пределе от 6 до 8 следовательно среда нейтральная.
Опыт №3. определение рН раствора при помощи универсальной индикаторной бумаги
Получили у преподавателя образец вещества из опыта №2. опустили в него лакмусовую бумагу, после чего проверили ее цвет по цветной шкале из чего ее рН=6.
Вывод: с помощью нескольких индикаторов можем определить рН данного раствора
Опыт №4. Определение рН раствора уксусной кислоты на рН-метре
Приготовили 50 мл 0,1М раствора уксусной кислоты из 1М уксусной кислоты. Для этого расчетное количество 1М раствора отобрали пипеткой или мерным цилиндром, после чего перенесли в мерную колбу на 50 мл и добавили до метки дистиллированной воды. Приготовленный раствор перелили в стакан на 50 мл и измерили значение рН раствора на рН-метре. Так мы определили практическое значение рН раствора.
рНпрак=2,6
Вычисляем теоретическое значение рН 0,1М раствора уксусной кислоты, учитывая, что константа диссоциации уксусной кислоты К = 1,86*10-5.
1 моль 1 л
0,005 моль х
х=0.005 л
СН3СООН=СН3СОО++Н-
[H+]=сα=с =0,1
моль/л*
=0,1
моль/л* =1,3*10-3
=1,3*10-3
рНтеор=-lg[H+]=-lg(1,3*10-3)=2,8
Рассчитываем относительную ошибку опыта.
 ŋ=
ŋ= %=2,8
– 2,6/2,8*100%=7,14 %
%=2,8
– 2,6/2,8*100%=7,14 %
Опыт №5. Определение рН раствора гидроксида натрия на рН-метре
Из 5 мл 0,05М раствора гидроксида натрия и 45 мл дистилированной воды получено 50 мл 0,005М раствора гидроксида натрия. Измеренное в данном растворе при помощи рН-метра значение рН составляет 11,7
f = 0,9
аOH- = 0,005 * 0,9 = 0,0045
pOH = - lg 0,0045 = 2,35
pH = 11,6
= (0,01/11,6) * 100% = 0,086%
Опыт 6. Колориметрический буферный метод определения рН.
а) Ориентировочное определение рН исследуемой жидкости по универсальному индикатору. Выбор буферной системы и индикаторов.
В чистую фарфоровую чешку наливают небольшое количество исследуемого раствора и с помощью универсальной индикаторной бумажки, пользуясь цветной шкалой, определяют приблизительное значение рН. Затем, пользуясь таблицей 1, выбирают индикатор и буферную смесь для приготовления растворов–эталонов и после этого занимают соответствующее рабочее место. Индикатор выбирают так, чтобы в зону перемены окраски его попадала ориентировочно найденная величина рН раствора.
Таблица 1. Значения рН буферных смесей – эталонов
Индикатор (зона перехода) |
Название буферных систем |
Объем, мл |
рН |
|
соли |
кислоты |
|||
Тимоловый синий (1,1–2,8) |
Цитратная (лимонная) |
1,0 2,5 |
4,0 2,5 |
2,3 2,9 |
Метилоранж (3,0–4,4) |
3,5 4,0 4,5 |
1,5 1,0 0,5 |
3,3 3,5 3,9 |
|
Метиловый красный (4,2–6,3) |
Ацетатная |
1,0 2,5 3,5 4,0 4,5 |
4,0 2,5 1,5 1,0 0,5 |
4,1 4,7 5,1 5,3 5,7 |
Бромтимоловый синий (6,0–7,6) или нейтральрот (6,5 – 8,0) |
Фосфатная |
1,0 2,5 3,5 4,0 4,5 |
4,0 2,5 1,5 1,0 0,5 |
6,2 6,8 7,2 7,4 7,7 |
б) Приготовление эталонов и определение рН исследуемой жидкости.
В чистых пронумерованных пробирках из бесцветного стекла и одинакового диаметра, пользуясь таблицей 1, готовят пять соответствующих буферных растворов-эталонов, затем в каждую из пробирок добавляют по 3 капли выбранного индикатора и растворы-эталоны перемешивают. В отдельную пробирку отмеривают пипеткой 5 мл исследуемого раствора, добавляют 3 капли того же индикатора и после перемешивания сравнивают окраску с окраской растворов–эталонов.
Примечание. При работе с цитратным буфером исследуемый раствор отмеривают в две пробирки и добавляют в них различные индикаторы (см. табл. 1), чтобы затем сравнивать окраску в каждой из них с соответствующими эталонами. При сравнивании окраски растворов следует пробирки поставить на белый лист бумаги и смотреть на растворы сверху. Значение рН исследуемой жидкости равно значению рН раствора–эталона, если их окраска совпадает.
Работу оформите в виде таблицы 2.
Таблица 2
Ориентировочная величина рН по универсальному индикатору |
Выбранный индикатор (указать зону перехода) |
Буферные растворы – эталоны |
Точная величина рН |
||||
Название и формулы компонентов |
Состав (мл) |
||||||
соль |
кис-лота |
рН |
|||||
|
|
|
|
|
|
|
|
Опыт 7. Определение рН раствора при помощи фотоколориметра КФК- 2МП.
а) Подготовка фотоколориметра КФК–2МП к работе в циклическом режиме.
Общий вид прибора:
9
|
1 – колориметр 2 – микропроцессорная система 3 – фотоприемник 4 – ручка смены кювет 5 – крышка кюветного отделения 6 – светофильтры 7 – сигнальная лампочка 8 – сеть 9 – пуск |
2
1 5
3
|
1. Присоедините прибор к сети, откройте крышку кюветного отделения (5) и на задней панели прибора слева включите тумблер «сеть» (8), при этом должна загореться сигнальная лампа (7) (на цифровом табло могут появиться различные символы).
2. Нажмите клавишу «пуск» - на цифровом табло появляется мигающая запятая и горит индикатор «р». Если запятая не появилась, повторно нажмите клавишу «пуск».
3. Выдержите колориметр во включенном состоянии в течение 15 мин. при открытой крышке кюветного отделения.
4. Ручкой (6) установите светофильтр 440 нм, а ручкой (3) — фотоприемник 315–540. Выдержите прибор с закрытой крышкой 5 мин. Если положение ручек (3) и (б) уже было установлено, как указано, операции п.4 можно опустить.
5. Измерение и учет темнового тока «n0». Крышку кюветного отделения закройте и через несколько секунд откройте опять. Через 5 с. нажмите клавишу «Ш (0)». На цифровом табло справа от мигающей запятой высвечивается значение n0, а слева – символ «0». Значение n0 необходимо для внутренней калибровки прибора, для расчетов вам оно не потребуется. Однако, если оно выходит за пределы промежутка от 0.001 до 1.000, следует пригласить преподавателя. После выполнения пунктов 1–5 прибор готов к работе. Крышку кюветного отделения следует оставить открытой.
б) Выбор индикатора и подготовка растворов для фотоэлектроколориметрирования.
1. В чистый фарфоровый тигелек пипеткой (на 10 мл) отмеряют 1 мл исследуемого раствора, добавляют 1 капли раствора универсального индикатора и, сравнивая получившуюся окраску раствора с цветной шкалой для универсального индикатора (приколота к полке), находят примерную величину рН раствора с точностью до 0.5 и записывают в протокол (таблицу).
2. Выбирают один из одноцветных индикаторов ряда нитрофенола (см. таблицу 3). Индикатор выбирают так, чтобы ориентировочно найденная по универсальному индикатору величина рН оказалась в пределах (примерно в средней части) зоны перехода окраски индикатора.
Таблица 3
№ п/п |
Индикатор |
Точка перехода окраски индикатора рК |
Зона перехода окраски индикатора |
I. |
-динитрофенол |
4,05 |
2,8–4,5 |
2. |
γ-динитрофенол |
5,15 |
4,0–5,5 |
3. |
п-нитрофенол |
6,18 |
5,2–7,0 |
4. |
т-нитрофенол |
8,31 |
6,7–8,4 |
3. В пробирку № 1 с помощью бюретки отмерьте 6 мл раствора карбоната натрия, а в пробирку № 2 — 6 мл исследуемого раствора (пипеткой). В обе пробирки добавляют пипеткой (на 1 мл) точно по 1 мл раствора выбранного индикатора. Содержимое пробирок хорошо перемешивают стеклянными палочками.
4. Одну из кювет прибора (с меткой "В" на дне кюветы) заполните растворителем (дист. водой), другую (с меткой "И") — щелочным раствором выбранного индикатора (проба № 1), а третью (с меткой "З") — исследуемым раствором (проба № 2),предварительно сполоснув эти кюветы небольшим объемом соответствующих растворов.
Примечание: Жидкости в кюветы наливают до метки по нижнему мениску. Рабочие поверхности кювет тщательно протирают сухой чистой марлей. При работе с кюветами нельзя касаться рабочих поверхностей кювет.
б) Измерение оптической плотности растворов в циклическом режиме (с периодом 5 с).
В дальнее гнездо кюветного отделения установите кювету с растворителем (дист. водой), а в ближнее — кювету со щелочным раствором выбранного индикатора (толщина поглощающего слоя кювет 1 см).
Закройте крышку кюветного отделения. Ручку (4) установите в положение "1" (в световой пучок вводится кювета с растворителем).
Нажмите клавишу "Пуск" и "Ц/Р". Вы выбрали циклический режим работы, о чем свидетельствует загорание индикатора "Ц" справа от табло. Прибор готов к выполнению измерений в цикле с интервалом в 5 с.
Нажмите клавишу "К(1)". На цифровом табло слева от мигающей запятой высвечивается символ "1". Это означает, что прибор измерил оптическую плотность раствора сравнения (дистиллированная вода).
Поверните ручку (4) из положения "1" в положение "2" (в световой пучок введена кювета с раствором индикатора).
Нажмите клавишу "Д(5)". На цифровом табло слева от мигающей запятой появляется символ "5", а справа — с интервалом 5 с. высвечивается значение измеренной величины оптической плотности раствора индикатора Динд.. Данные измерений заносят в таблицу 4.
Откройте крышку кюветного отделения. Вместо кюветы с раствором индикатора поставьте кювету с исследуемым раствором (из пробирки № 2) и произведите замеры оптической плотности Диссл., повторив операции по пунктам раздела б). Пригласите преподавателя для проверки результатов работы .
Окончание работы.
1. Отключить тумблер "сеть" на задней панели прибора, выключить прибор из сети.
2. Вымыть кюветы дистиллированной водой и протереть марлей досуха (снаружи) рабочие поверхности кювет.
3. Вымыть пробирки, тигелек и пипетки. Рабочее.место привести в порядок.
Оформление отчета по работе:
1.
По формуле α =
 рассчитать
степень диссоциации индикатора в
исследуемом растворе
рассчитать
степень диссоциации индикатора в
исследуемом растворе
2.
По уравнению рН = рК + lg
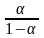 рассчитайте
рН исследуемого раствора, где рК — точка
перехода окраски индикатора (см. табл.
3).
рассчитайте
рН исследуемого раствора, где рК — точка
перехода окраски индикатора (см. табл.
3).
Данные занесите в таблицу 4:
Таблица 4
1. |
Ориентировочное значение рН раствора |
|
2 |
Выбранный индикатор (название, зона перезода окраски, рК) |
|
3. |
Оптическая плотность раствора индикатора Динд |
1. 2. 3. 4. 5. ──── ср.= |
4. |
Оптическая плотность исследуемого раствора Диссл |
1. 2. 3. 4. 5. ──── ср.= |
5. |
Степень диссоциации индикатора в растворе α |
|
6. |
рН исследуемого раствора |
|

 7
6 4
7
6 4