
- •Вывод формулы тонкой линзы.
- •Оптика. Учение о свете.
- •Волновые свойства.
- •Квантовые свойства света.
- •1. Масса.
- •3. Импульс.
- •Волновая оптика. Интерференция света - перераспределение света в пространстве.
- •Способы получения когерентных волн.
- •Дифракция света.
- •П ринцип Гюйгенса-Френеля.
- •Дифракция на щели.
- •Дифракционная решетка.
- •Вопрос 1: сколько углов дифракции может быть? (любое или конечное)
- •Вопрос 2: что представляет собой картина на экране в случае дифракционной решетки?
- •Поляризация света.
- •Квантовая оптика.
- •Фотоэффект.
- •Тепловое излучение.
- •Атомная физика.
- •Квантовая механика (волновая).
- •1. Гипотеза Луи де Бройля. 1924 г.
- •Принцип неопределенности.
- •Основное уравнение квантовой механики.
- •1. Значение энергии.
- •2. Значение волновой функции.
- •Применение квантовой механики для объяснения электрических свойств различных твердых тел.
- •Состав и характеристика атомного ядра.
Основное уравнение квантовой механики.
1926г. Уравнение Шредингера.
![]()
m- масса частицы.
E- полная энергия частицы.
![]() -
пси-функция (волновая функция).
-
пси-функция (волновая функция).
![]() -
оператор Лапласа.
-
оператор Лапласа.
![]()
С помощью
описывается
поведение микрочастицы в данный момент
времени.
![]() ,
так как это поведение носит вероятностный
характер, то с помощью
надо
умерь рассчитывать вероятность
обнаружения микрочастицы в данном
объеме пространства. А, так как вероятность
действительная и положительная, то за
меру вероятности берут не саму
,
а квадрат ее модуля.
,
так как это поведение носит вероятностный
характер, то с помощью
надо
умерь рассчитывать вероятность
обнаружения микрочастицы в данном
объеме пространства. А, так как вероятность
действительная и положительная, то за
меру вероятности берут не саму
,
а квадрат ее модуля.
![]() -
плотность
вероятности (вероятность [W]
обнаружения частицы в данный момент
времени в единичном объеме)
-
плотность
вероятности (вероятность [W]
обнаружения частицы в данный момент
времени в единичном объеме)
![]() ;
;
![]() -
вероятность достоверного события.
-
вероятность достоверного события.
Итак. Решив уравнение, получаем значение ; зная ее можем рассчитать вероятность нахождения частицы в данный момент времени в данном объеме пространства. Чтобы была объективной характеристикой поведения микрочастицы, она должна обладать следующими свойствами:
1. Непрерывность.
Разрыв может приводить к неверным результатам при расчете вероятности.
2. Однозначность, чтобы не было неоднозначности при расчете вероятности.
3. Конечность, потому что вероятность не может быть больше 1.
В теории дифференциального уравнения подобного типа (2-го порядка частных производных) доказывается, что решения, удовлетворяющие свойствам непрерывности, имеют место только при определенных значениях параметра, входящего в это уравнение. Таким параметром в данном уравнении является Е (энергия микрочастицы). Следовательно, из уравнения Шредингера без каких-либо постулатов вытекает дескретный ряд значений полной энергии микрочастицы.
Применение уравнения (1) к атому водорода.
![]()
Решение уравнения дает:
1. Значение энергии.
![]() ;
n=1,2,3…
;
n=1,2,3…
2. Значение волновой функции.
dV- объем, в котором находится частица.
dW- вероятность нахождения частицы в заданном объеме.
Т.к. электрон в
атоме имеет три степени свободы (i=3),
то
является
функцией трех квантовых чисел (![]() ).
).
n- главное квантовое число (n=1,2,3…).
l- азимутальное (орбитальное) квантовое число (l=0,1,2,…,n-1). l принимает n различных значений.
m-
магнитное квантовое число (![]() ).
m
принимает
2l+1
различных значений.
).
m
принимает
2l+1
различных значений.
Сколько может быть различных состояний электрона с одним и тем же значением n?
![]() Не может быть двух
состояний (электронов), в которых все
квантовые числа одинаковые.
Не может быть двух
состояний (электронов), в которых все
квантовые числа одинаковые.
Под термином: «различные квантовые состояния» понимаются состояния, которые отличаются значение хотя бы одного квантового числа.
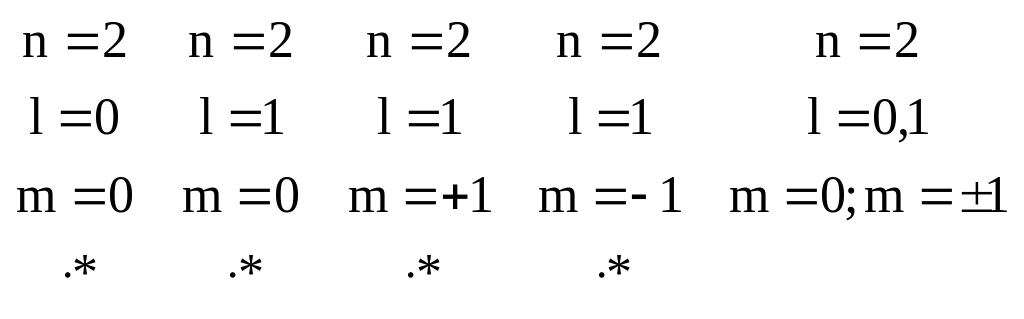 Это есть принцип
Паули для электрона в атоме (n2).
Это есть принцип
Паули для электрона в атоме (n2).
(![]() )-обозначение
двух противоположных направления
собственных спиновых моментов (Mzs).
)-обозначение
двух противоположных направления
собственных спиновых моментов (Mzs).
Состояние с l=0 называется s–состоянием; с l=2 называется р–состоянием; с l=3 называется d–состоянием.
Физический смысл квантовых чисел.
1. n-
главное квантовое число (=1,2,3…).
Определяет энергию
![]() .
Данная величина дискретная, строго
определенная.
.
Данная величина дискретная, строго
определенная.
2. l- азимутальное (орбитальное) квантовое число (l=0,1,2,…,n-1). Определяет момент импульса на орбите (орбитальный механический момент). Определяет форму орбиты.
Рис.1.8.
М![]() плоскости
орбиты. Из уравнения Шредингера следует
плоскости
орбиты. Из уравнения Шредингера следует
![]() .
Данная величина дискретная, строго
определенная.
.
Данная величина дискретная, строго
определенная.
3. m-
магнитное квантовое число (![]() ).
Определяет проекцию момента импульса
на ось. Определяет ориентацию орбиты в
пространстве.
Mz=m
-
дискретная
величина.
).
Определяет проекцию момента импульса
на ось. Определяет ориентацию орбиты в
пространстве.
Mz=m
-
дискретная
величина.
Рис.1.9.
Пример.
Электрон находится
в р-состянии (l=1,
m=0,![]() 1).
Следовательно, Mz=0,
Mz=+
;-
1).
Следовательно, Mz=0,
Mz=+
;-
Итак.
1. , описывающая поведение электрона в атоме, является функцией трех квантовых чисел, так как электрон в атоме имеет три степени свободы.
2. В каждом квантовом состоянии, которому соответствуют определенные значения квантовых чисел l, m и n, электрон обладает определенными (дискретными) значениями трех характеристик: En, M, Mz.
3. В 1930г. Гауцмитом и О… было установлено, что электрон обладает собственным механическим моментом, который получил название спина.
Msz=ms ; ms= S
ms- спиновое магнитное квантовое число.
S- спиновое число.
Sэл=1/2;
Mzs=![]()
Mzs- проекция на заданное направление.
Полный момент
электрона
![]()
4. С у четом спина полный набор квантовых чисел есть n,l,m. Первые три связаны с движением электрона в атоме, четвертый – с собственным свойством электрона.
Полный набор собственных характеристик электрона тоже 4: E, M, Mzs, Mz.
5. Так как в каждом квантовом состоянии электрон имеет две ориентации спина, то число различных квантовых состояний, соответствующих определенному значению n будет 2n2 – принцип Паули для электрона в атоме.
6. Так как зависит от квантовых чисел, смысл которых разобран, то, следовательно, известно значение . А, зная , можно рассчитать вероятность обнаружения электрона в атоме водорода в различных квантовых состояниях.
Рис.2.
Следовательно, радиусы боровских орбит соответствуют расстояниям, на которых максимальна вероятность обнаружения электрона в атоме, но электрон может быть ближе и дальше этого расстояния с меньшей вероятностью. Следовательно, движение электрона в атоме есть некое электронное облако (форму определяет l), плотность которого максимальна на расстояниях, соответствующих боровским радиусам орбит. Вкладывая такой смысл в боровские радиусы, можно сохранить понятие орбит.
7. Отличительные особенности квантовой механики: вероятность поведения частиц, и дискретность всех характеристик частиц.
Рис.2.1
