
- •Общий план строения клетки
- •Поверхностный аппарат клетки
- •Цитоплазма и ее основные органоиды
- •Строение и функции клеточного ядра
- •Особенности строения клетки прокариот
- •Химические элементы и неорганические вещества в биосистемах
- •Органические вещества в биосистемах
- •Углеводы и липиды клетки
- •Строение и функции белков
- •Структура и функции нуклеиновых кислот
- •Другие производные нуклеотидов
Строение и функции белков
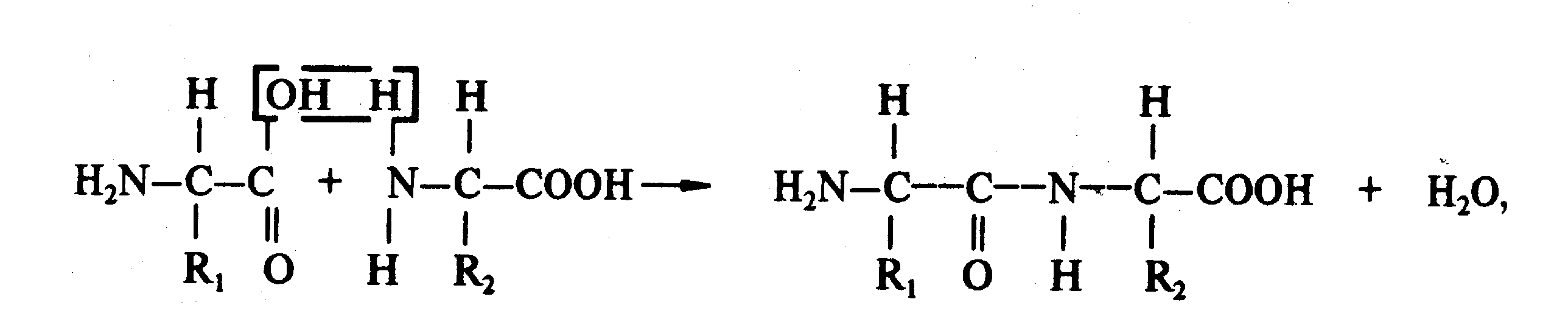
Белки представляют собой высокомолекулярные (молекулярная масса до 1,5 млн. ед.) полимеры aльфа-аминокислот, соединенных пептидной связью
где R1 и R2 — углеводородные радикалы, имеющие различную структуру в молекулах разных аминокислот.
Реакция образования пептидной связи в водном растворе может происходить только в присутствии катализаторов (ферментов), с большой затратой энергии и в строго определенных условиях. Совокупность связанных между собой аминокислотных остатков образует полипептидную цепь, или первичную структуру белка. В ее образовании принимает участие 20 аминокислот, которые могут иметь как линейное, так и циклическое строение, могут содержать серу, а также дополнительные амино- и карбоксильные группы. Соединения, имеющие в основе своих молекул цепочки аминокислот с пептидными связями между ними, называются полипептидами. В организме имеется большое количество низкомолекулярных пептидов, многие из которых выполняют важные биологические функции (например, часть из них является гормонами).
В молекуле белка после образования первичной структуры отдельные участки полипептидной цепи сохраняют способность к взаимодействию с образованием водородных связей между рядом расположенными амино- и карбонильными группами. В результате полипептидная цепь скручивается в спираль или складчатость, которая представляет собой вторичную структуру белка. На этом возможности внутримолекулярного взаимодействия не исчерпываются. Вследствие отталкивания от окружающих молекул воды отдельные участки спирали сближаются и молекула приобретает вид плотного комка. Между серусодержащими аминокислотными остатками образуются дисульфидные мостики (так называемые —S—S-связи). Гидрофобное взаимодействие создает третичную структуру белка, которая иногда включает несколько связанных дисульфидными мостиками полипептидных цепей. В некоторых случаях формируется четвертичная структура в виде сложных межмолекулярных комплексов за счет различных по природе сил физико-химического взаимодействия. В образовании четвертичной структуры могут принимать участие наряду с белками и другие вещества. Так, клеточные мембраны образованы совместной структурой белков и жироподобных веществ из группы фосфолипидов (липопротеид). В составе клеточных мембран содержатся также компоненты, образованные совместной структурой белков и углеводов - гликопротеиды. Хромосомы и рибосомы образуются в результате взаимодействия белков и нуклеиновых кислот (нуклеопротеиды). Некоторые белки включают группы, содержащие атомы металлов (хромопротеиды). К числу таких веществ относится гемоглобин, молекула которого помимо белковой цепи содержит углеводородные радикалы с включенными атомами железа.
Важнейшим свойством белков, во многом определяющим их биологические функции, является способность изменять свою структуру под действием разнообразных физических и химических факторов. Денатурацией белка называется последовательное нарушение четвертичной, третичной и вторичной структур при сохранении первичной; разрушение последней представляет собой деструкцию молекулы.
Факторы, вызывающие денатурацию, могут иметь самую различную природу. К ним относятся температура, различные виды радиоактивного и рентгеновского излучения, изменения кислотности или иных химических свойств окружающей молекулу среды. Денатурация может быть обратимой и необратимой. В первом случае после возвращения к исходным условиям молекула самостоятельно восстанавливает свою структуру. Именно способность белков к обратимым структурным и функциональным перестройкам определяет их биологические функции.
Во втором восстановления структуры белка не происходит ввиду блокировки функциональных групп, ответственных за образование водородных связей во вторичной структуре. Так, необратимая денатурация некоторых белков наступает при температуре свыше 42 °C, а при 90 °C денатурируются практически все белки (на этом явлении основана обработка пищевых продуктов путем пастеризации).
Формирование вторичной, третичной и четвертичной структур белковой молекулы представляет собой ее переход к состоянию с наименьшей внутренней энергией, поэтому химическая активность белка в результате обратимой денатурации всегда возрастает. Это свойство особенно важно, поскольку благодаря ему становится возможной активация молекулы в нужный момент из-за изменения окружающих условий.
Функции белков. Формируя комплексы с липидами в клеточных мембранах, а с нуклеиновыми кислотами в хромосомах и рибосомах, белки выполняют структурную функцию. Не менее важной является каталитическая функция. Большинство реакций обмена веществ протекает в присутствии катализаторов, в роли которых выступают белки-ферменты. Транспортная функция осуществляется особым классом белков, способных к временному соединению с молекулами, которые транспортируются в пределах клетки или многоклеточного организма. Примером транспортного белка является гемоглобин, обеспечивающий перенос кислорода клетками крови. Способность белков к обратимым перестройкам при изменении химического состава среды лежит в основе сократительной (двигательной) функции. Так, сократительный аппарат мышечных клеток образован совместной четвертичной структурой двух белков — миозина и актина. При возбуждении мышечной клетки в цитоплазме резко возрастает концентрация ионов кальция, поступающих из внешней среды и цистерн эндоплазматической сети. В результате следующей за этим перестройки, значительно уменьшаются линейные размеры актин-миозинового комплекса, вследствие чего мышечные клетки (волокна) сокращаются. Сходные процессы лежат в основе работы жгутиков, ресничек и других клеточных органоидов движения. Окисление белков до низкомолекулярных продуктов обеспечивает их энергетическую функцию. Белки являются весьма энергоемкими соединениями, не уступающими по калорийности основному источнику энергии — углеводам. Однако при их расщеплении происходит выделение побочных продуктов в виде соединений азота, которые необходимо выводить из организма. Кроме того, аминокислоты пищевых белков значительно в большей мере используются для построения специфических белков организма.
Обратимая денатурация лежит в основе рецепторной, или чувствительной функции белков. Способность клеток воспринимать температурные, химические, механические и другие воздействия определяется в конечном итоге наличием в их составе белков, изменяющих свою структуру под действием этих факторов.
Особо следует выделить защитную функцию белков. Она связана с тем, что белки, будучи полимерами аминокислот, способны образовывать астрономическое, практически не поддающееся учету количество изомеров, в которых аминокислотные остатки расположены в разном порядке. Среди таких изомеров встречаются как вещества, почти неотличимые друг от друга по биологическим свойствам (обладающие сходной вторичной и третичной структурами), так и сильно отличающиеся друг от друга. Механизм передачи наследственной информации не предусматривает полного копирования белкового состава у различных особей. Это создает основу изменчивости организмов. То же самое относится к нуклеиновым кислотам, поэтому считают, что эти два класса соединений обладают видовой и индивидуальной специфичностью.
В процессе эволюции у организмов выработалась способность реагировать на попадание во внутреннюю среду чужеродных высокомолекулярных соединений (антигенов). Это защитное свойство, направленное в естественных условиях на борьбу с паразитами и продуктами их жизнедеятельности, называется иммунитетом. Одним из самых мощных механизмов иммунитета является выработка антител — особых белковых веществ, которые вступают во взаимодействие с антигеном и нейтрализуют его.
