- •Задание 2. Гель-хроматография на колонке сефадекса g-75
- •Практические указания:
- •Задание 4. Электрофорез белков в полиакриламидном геле в присутствии ддс-Na
- •Практические указания:
- •Сборка сэндвич-кассеты для заливки геля.
- •Формирование пааг (размер геля 8 х 7,3 см):
- •3. Сборка электрофоретического модуля:
- •4. Нанесение проб:
- •5. Подключение электрофоретической камеры к источнику питания и проведение электрофореза:
Практическое занятие №2
«Физико-химические свойства белков. Аминокислотный состав белков.
Электрофоретические и хроматографические методы»
Задание 1. Разделение аминокислот хроматографией на бумаге
Для быстрого разделения аминокислот можно воспользоваться методом круговой хроматографии на бумаге (используют специальную фильтровальную бумагу).
Ход работы: Раствор смеси трех аминокислот (0,002 мл) наносят в центр фильтра и высушивают на воздухе. Фильтр помещают между половинками чашки Петри, нижняя из которых наполовину заполнена растворителем: н-бутанол + ледяная уксусная кислота + вода (12:3:5). Через 1,5–2 часа, когда диаметр растворителя составит 4–6 см, фильтр высушивают для удаления растворителя и разрезают на две части.
А) Первую половину фильтра (хромотограммы) быстро проводят через раствор нингидрина в ванночке и помещают в сушильный шкаф (при температуре 80–100С) на 5–10 мин. На диске появляются три окрашенных кольца, соответствующие гистидину, аланину и тирозину.
Химические реакции: Нингидрин реагирует с аминокислотами следующим образом:
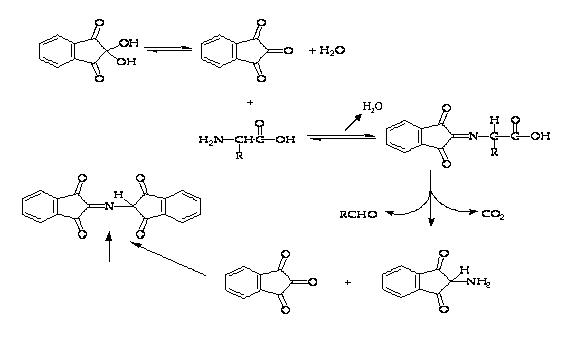
Окрашенное
соединение (максимум поглощения при
570 нм)
Б) Вторую половину фильтра используют для выявления гистидина и тирозина с помощью реакции Паули. Для этого ½ фильтра (хромотограмму) проводят через раствор диазобензолсульфоновой кислоты, высушивают, проводят через 10%-ный раствор карбоната натрия и высушивают. Гистидин окрашивается в красный, а тирозин в оранжевый цвет. Реакция Паули протекает следующим образом:


Задание 2. Гель-хроматография на колонке сефадекса g-75
|
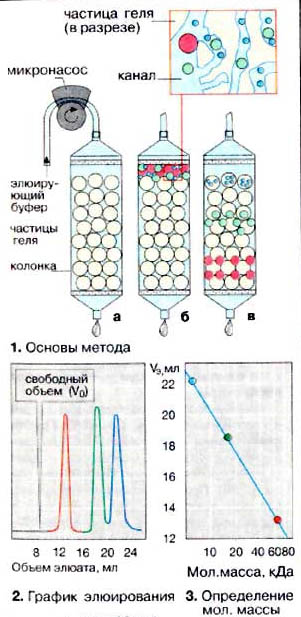
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков (1б) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля (1в). На выходе колонки элюат собирают в виде отдельных фракций (2). Объем выхода того или иного белка зависит в основном от его молекулярной массы (3).
|
|
Сефадекс представляет собой полимеризованный декстран, формируемый в виде бусин. Сефадекс готовиться поперечным сшиванием декстрановых цепей эпихлоргидрином. Благодаря высокому содержанию гидроксильных групп в полисахаридных цепях Сефадекс сильно гидрофилен и потому набухает в воде и растворах электролитов. Степень набухания, как и размер пор в гранулах Сефадекса зависит от степени сшитости декстрановых цепей: чем выше соотношение декстран: эпихлоргидрин, тем больше число поперечных сшивок, тем меньше размер пор и степень набухания. |
Практические указания:
Необходимое оборудование и реактивы:
Колонка с адаптером фирмы Pharmacia XK 1,0 х 40 см на штативе,
заполненная сефадексом G-75;
Коллектор фракций 2112/2212 Heurac фирмы LKB;
Пробирки для сбора фракций;
Элюирующий буфер – 0,9%-ный раствор NaCl.
Ход работы:
1. Нанесение пробы: Для аналитических целей, когда основной задачей является достижение возможно лучшего разделения, стартовая зона должна быть узкой. Образец вносят с помощью перистальтического насоса, скорость внесения составляет ½ от скорости элюции; объем анализируемой пробы 1 мл.
Голубой декстран – 1 мг
Гемоглобин – 2.5 мг
Цитохром С – 1,5 мг в 1 мл 0,9%-ном NaCl
К2CrO4 – 2 мг
Сахароза – 200 мг (для уплотнения анализируемой пробы)
2. Параметры элюции: Движение элюирующего буфера осуществляют с помощью перистальтического насоса. В качестве элюента используют – 0,9%-ный раствор NaCl. Скорость протекания элюента через колонку составляет 15 мл/час.
3. Сбор фракций: Фракции собирают с помощью коллектора фракций. Объем фракции зависит от параметров колонки, объемов образца и его состава, а также соотношения высоты стартовой зоны и длины гелевого ложа. При аналитической хроматографии объем собираемых фракций, как правило, не превышает 3,5 мл. При разделении ограниченного числа окрашенных компонентов, существенно отличающихся по величинам Кav, объем может достигать 5 мл.
4. Детекция хроматографических зон: Детекция хроматографических зон, соответствующих отдельным белкам, может осуществляется измерением оптической плотности отдельных фракции при 280 нм или 230 нм. Результаты измерения представляются в виде зависимости между оптической плотностью фракций и объемом элюата, вышедшего с колонки, или временем хроматографического разделения. При использовании проточного адаптора, перистальтического насоса, UV- монитора, самописца (или компьютера) и коллектора фракций измерение оптической плотности, вычерчивание графика элюции и сбор фракций осуществляются автоматически. При разделении окрашенных компонентов интенсивность окраски фракций оценивают спектрофотометрически в видимой области спектра или визуально.
5. Анализ и оформление полученных результатов: Рассчитать Ve, Vt, Vo, Vi, Kav
6. Промывка колонки: После завершения хроматографии колонку с сефадексом промывают 2-3 объемами раствора 0,9%-ного NaCl.
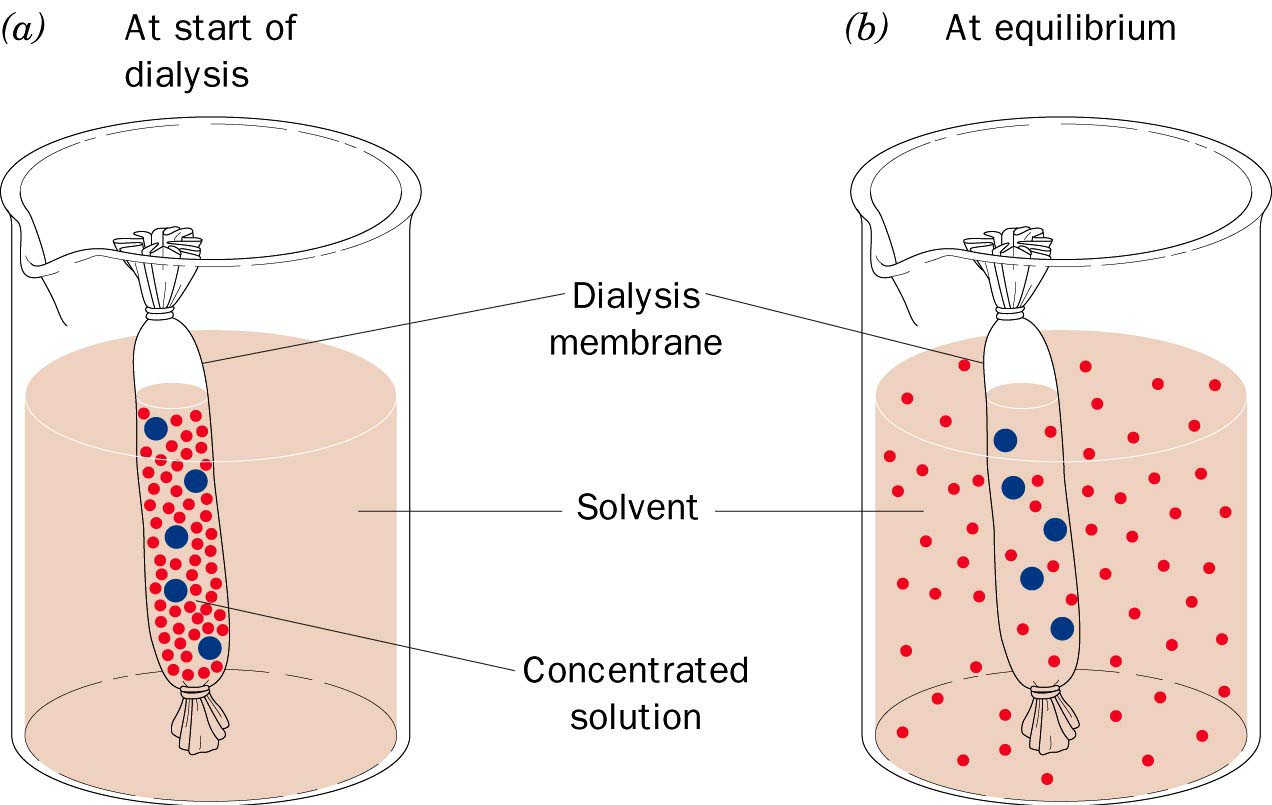
Задание 3. Проведение диализа
Диализ является одним из способов отделения белков от низкомолекулярных веществ. Крупные молекулы, такие как молекулы белков, остаются внутри диализного мешочка, сделанного из материала, содержащего ультрамикроскопические поры (строго калиброванного размера). Если такой мешочек с раствором белка поместить в буферный или водный раствор, то содержащиеся там небольшие молекулы, например, ионы солей, пептиды, другие низкомолекулярные вещества пройдут через поры, а высокомолекулярные молекулы белков, молекулярная масса которых превышает 15 кДа, останутся внутри мешочка. Для иллюстрации принципа диализа поместите смесь высокомолекулярного вещества голубого декстрана (молекулярная масса 2000000 Да) и низкомолекулярного бихромата калия в диализный мешочек. Оба эти вещества окрашены: первое – в синий цвет, а второе – в оранжево-желтый цвет. За ходом диализа удобно следить по изменению цвета растворов внутри мешочка и в сосуде для диализа: низкомолекулярная соль (бихромат калия) будет выходить в раствор, окрашивая его в желтый цвет.