
- •Объекты анализа
- •Основные этапы анализа.
- •Виды анализа
- •Методы анализа
- •Лекция № 2 Способы выражения концентрации растворов
- •Титриметрический анализ.
- •Методы титрования.
- •Метод пипетирования-
- •Метод отдельных навесок- Способы титрования
- •Расчет результатов титрования
- •Лекция № 3 Теоретические основы реакций кислотно-основного взаимодействия
- •Расчет рН водных растворов кислот, оснований, солей.
- •Слабые основания
- •Гидрализующие соли
- •Амфолиты
- •Буферные растворы
- •Кислотно-основное титрование.
- •И установочные вещества
- •Кислотно-основные индикаторы
- •Кривые кислотно-основного титрования
- •Виды кривых титрования
- •Правило выбора индикатора
- •Лекция № 4 Комплексоно-метрическое титрование
- •Характеристика комплексных соединений
- •Равновесие в растворах комплексных соединений
- •Влияние температуры на равновесия в растворах комплексных соединений.
- •Рабочие растворы
- •Условия комплексонометрического титрования
- •Строение внутрикомплексных солей
- •Фиксирование точки эквивалентности проводят с помощью металлиндикаторов
- •Типы металлиндикаторов:
- •Требования к металлиндикаторам
- •Кривые комплексонометрического титрования
- •Методы комплексонометрического титрования
- •Лекция № 5 Окислительно-восстановительное титрование (редоксиметрия).
- •Теоретические основы реакций окисления-восстановления.
- •Молярная масса эквивалента в реакциях окисления – восстановления
- •Константы равновесия окислительно-восстановительной реакции
- •Классификация методов овт
- •Перманганатометрия
- •Дихроматометрия
- •Лекция № 6 Осадительное титрование
- •Классификация методов осадительного титрования
- •Применение метода
Влияние температуры на равновесия в растворах комплексных соединений.
Зависимость константы устойчивости от температуры имеет вид:
![]()
Где Н – тепловой эффект реакции, кДж/моль,
R- универсальная газовая постоянная, равная 8,31 Дж/мольК,
Т – абсолютная температура, К.
При протекании экзотермических реакций (Н0) константы устойчивости с ростом температуры уменьшаются, а при протекании эндотермических – увеличиваются. Температурная зависимость констант устойчивости многих координационных соединений имеет вид вогнутой параболы, т.е. с ростом температуры устойчивость проходит через минимум.
Рабочие растворы
Комплексоны – органические производные аминополикарбоновых кислот
Наиболее часто используют три
Комплексон I – это трехосновная нитрилотриуксусная кислота (НТА): H3Y

Комплексон II –этилендиаминтетрауксусная кислота (ЭДТА): H4Y
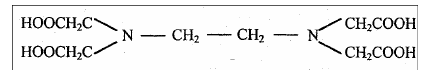
Этот реагент образует шестидентантный лиганд, поскольку он может координироваться с ионом металла двумя атомами азота и четырьмя атомами кислорода карбоксильных групп. Комплексон II – это четырехосновная кислота и обозначается обычно H4Y , где Y4- – этилендиаминтетраацетат-ион.
Белое кристаллическое вещество, малорастворимое в воде (при 200 С – 28,3 мг в 100 мл воды) и мин. при рН=1,6-1,8. В водных растворах в зависимости от рН могут существовать 5 форм ЭДТА м.д которыми устанавливается равновесие:
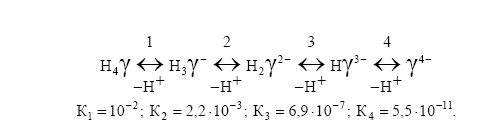
Константы устойчивости комплексов ионов с ЭДТА приводятся в справочнике Лурье и чем выше устойчивость образовавшегося комплекса, тем ниже значение рН комплексонометрического титрования.
На практике применяют двунатриевую соль этилендиаминтетрауксуснoй кислоты, комплексон III, или трилон Б: Na2H2Y2H2O (дигидрат)
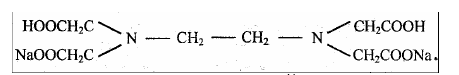
Рабочий раствор комплексона III готовят по точной навеске. Эта соль легко получается в чистом виде, хорошо растворяется в воде, ее растворы устойчивы при хранении.
Условия комплексонометрического титрования
Реакции взаимодействия катионов с комплексоном III могут быть представлены в следующем виде:
Na2H2Y 2Na+ + H2Y2-
Mg2+ + H2Y2- MgY2- + 2H+
Fe3+ + H2Y2- FeY- + 2H+
Zr4+ + H2Y2- ZrY + 2H+
при комплексообразовании независимо от заряда катиона всегда выделяется два иона водорода (молярная масса эквивалента определяемого катиона равна половине его атомной массы, а молярная масса эквивалента титранта – половине его молярной массы).
М(1/2Na2H2Y)=1/2∙372,25=186,125 г/моль∙экв
при комплексообразовании рН раствора понижается, поэтому комплексонометрическое титрование проводят при постоянном значении рН в присутствии соответствующего буфера (во избежание разрушения комплекса).
Строение внутрикомплексных солей
Молекула ЭДТА в своем составе содержит четыре подвижных атома водорода карбоксильной группы и два атома азота, каждый из которых имеет неподеленную электронную пару (рис.), и поэтому обладает потенциальной возможностью образовывать шесть связей с ионами металла и может рассматриваться, как шестидентантный лиганд.
Внутрикомплексные соли ЭДТА с ионами металлов образуются в результате замещения ионами металла двух активных атомов водорода карбоксильных групп и одновременного донорно-акцепторного (координационного) взаимодействия с атомами азота.
Строение внутрикомплексной соли состава CuH2Y схематично:
