
- •Объекты анализа
- •Основные этапы анализа.
- •Виды анализа
- •Методы анализа
- •Лекция № 2 Способы выражения концентрации растворов
- •Титриметрический анализ.
- •Методы титрования.
- •Метод пипетирования-
- •Метод отдельных навесок- Способы титрования
- •Расчет результатов титрования
- •Лекция № 3 Теоретические основы реакций кислотно-основного взаимодействия
- •Расчет рН водных растворов кислот, оснований, солей.
- •Слабые основания
- •Гидрализующие соли
- •Амфолиты
- •Буферные растворы
- •Кислотно-основное титрование.
- •И установочные вещества
- •Кислотно-основные индикаторы
- •Кривые кислотно-основного титрования
- •Виды кривых титрования
- •Правило выбора индикатора
- •Лекция № 4 Комплексоно-метрическое титрование
- •Характеристика комплексных соединений
- •Равновесие в растворах комплексных соединений
- •Влияние температуры на равновесия в растворах комплексных соединений.
- •Рабочие растворы
- •Условия комплексонометрического титрования
- •Строение внутрикомплексных солей
- •Фиксирование точки эквивалентности проводят с помощью металлиндикаторов
- •Типы металлиндикаторов:
- •Требования к металлиндикаторам
- •Кривые комплексонометрического титрования
- •Методы комплексонометрического титрования
- •Лекция № 5 Окислительно-восстановительное титрование (редоксиметрия).
- •Теоретические основы реакций окисления-восстановления.
- •Молярная масса эквивалента в реакциях окисления – восстановления
- •Константы равновесия окислительно-восстановительной реакции
- •Классификация методов овт
- •Перманганатометрия
- •Дихроматометрия
- •Лекция № 6 Осадительное титрование
- •Классификация методов осадительного титрования
- •Применение метода
Дихроматометрия
Рабочий раствор: K2Cr2O7.
Титрованный раствор можно приготовить по тонной навеске, поскольку кристаллический K2Cr2O7 удовлетворяет всем требованиям первичного стандарта. Раствор бихромата калия устойчив при хранении, титр раствора остается неизменным длительное время
Основной реакцией метода бихроматометрии является реакция окисления бихроматом калия в
кислой среде:
![]()
Точку эквивалентности фиксируют, используя редокс-индикаторы (дифенил амин и его производные).
Бихроматометрический метод используют для определения восстановителей – прямое титрование (Fe2+, U4+,Sb3+,Sn2+), окислителей-обратное титрование (Cr3+), а также некоторые органические соединения (метанол, глицерин).
Лекция № 6 Осадительное титрование
Метод титриметрического анализа, основанный на применении титрантов, образующих с анализируемым веществом малорастворимые соединения.
Пример: Ag+ + I- → AgI↓
2I- + Mg2(NO3)2 → Mg2I2↓ + 2NO3-
3Zn2+ + 2K4[Fe(CN)6] → K2Zn3[Fe(CN)6]2 + 6K+
Растворимость и
произведение растворимости
Ионные равновесия, связанные с осаждением и образованием осадков, являются обратимыми, подчиняются закону действия масс и характеризуются константой равновесия, так называемым произведением растворимости (ПР).
ПР – постоянная величина (Т, р, растворитель), равная произведению активных концентраций ионов в степенях их стехиометрических коэффициентах в насыщенном растворе малорастворимого электролита.
В общем виде для малорастворимого электролита:
MmAa ↔ mM + aA
ПРMmAa=[M]m ∙ [A]a
[M], [A]-равновесные концентрации ионов, моль/л.
Величины ПР даны в справочных таблицах.
1 следствие: если концентрация одного из ионов, входящих в произведение растворимости уменьшается, то концентрация другого увеличивается и наоборот.
2 следствие: если ПРMmAa > [M]m ∙ [A]a, то осадок будет растворятся,
ПРMmAa < [M]m ∙ [A]a, выпадение осадка.
Для сравнения растворимости осадков пользуются не величинами ПР, а растворимостью.
Растворимость (S) – общая концентрация вещества в его насыщенном растворе, складывается из концентрации всех форм вещества, в котором оно присутствует в растворе и связано с ПР следующим соотношением:
![]()
Для малорастворимого соединения:
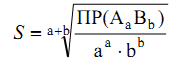
Факторы, влияющие на растворимость
влияние одноименного иона (эффект одноименного иона): при увеличении концентрации одноименного иона, S уменьшается (и наоборот).
влияние конкурирующих (побочных) реакций: учитывается с помощью Ме=См/[M]-коэффициент побочной реакции комплексообразования и Ме=СА/[А]- коэффициент побочной реакции протонирования.
влияние ионной силы раствора (солевой эффект)
![]() ,
,
где [i]-равновесная молярная концентрация i-го иона, zi-заряд иона. С увеличением ионной силы раствора, растворимость увеличивается.
температура:
![]()
Н – тепловой эффект реакции, кДж/моль. При протекании экзотермических реакций (Н0) растворимость с ростом температуры увеличивается, а при протекании эндотермических – уменьшается.
влияние природы растворителя: растворитель и растворяемое вещество должны быть одной хим.природы (неорганические вещества лучше растворяются в воде, а органические в органических растворителях.)
