
- •Предмет биофизики, ее значение для медицины
- •Часть первая основы общей биофизики
- •Процессов
- •1 От греч. «kybernetike»— искусство управления.
- •Теория регулирования
- •Глава 2 термодинамика биологических систем предмет и терминология
- •Глава 3 квантовая биофизика
- •Поглощение света
- •Значение
- •Глава 4 кинетика биохимических процессов
- •7 Медицинская биофизика 97
- •8 Медицинская биофизика
- •Часть вторая биофизика клетки
- •Глава 5 ультраструктура клетки и биологических мембран
- •Методы исследования
- •Общая структура клетки
- •Мембран
- •9 Медицинская биофизика
- •Адгезия клеток
- •Искусственные мембраны
- •Глава 6 проницаемость живых клеток
- •Методы изучения проницаемости
- •Диффузия
- •10) Медицинская биофизика 145
- •Фильтрация
- •В клетку
- •11 Медицинская биофизика
- •Глава 7 биоэлектрические потенциалы
- •Потенциал покоя
- •Проведение возбуждения
- •13 Медицинская биофизика 193
- •Передача возбуждения в синапсах
- •Глава 8 электрокинетические явления
- •Электроосмос
- •Глава 10
- •Биологическое действие ионизирующих излучений
- •16» Медицинская биофизика
- •Действие ультразвука на клетки
- •Часть третья элементы частной биофизики
- •Глава 11 биофизика мышечного сокращения
- •Глава 12 биофизика кровообращения
- •Анализ работы сердца
- •Глава 13 элементы биофизики органов чувств общие закономерности
- •Восприятие вкуса
- •Кодирование информации в органе слуха
- •Глава 14 биофизика внешнего дыхания
- •Сопротивление дыханию
- •21 Медицинская биофизика
Значение
Молекулы могут переходить в возбужденное состояние не только при поглощении квантов света, но и за счет химического взаимодействия с другими молекула-
84
ми. В последующем при переходе молекул в основное состояние может возникнуть свечение, называемое хемилюминесценцией. Спонтанная хемилюминесценция делится на три основных вида: митогенетическое излучение, биолюминесценция, или экзотическая люминесценция, и сверхслабое свечение. Необходимым условием всех видов хемилюминесценции является химическая реакция окисления.
Митогенетическое излучение — это ультрафиолетовое излучение (190—320 нм), субстратом которого служат белки и углеводы. По мнению А. Г. Гурвича (1923), это излучение стимулирует клеточное деление.
Биолюминесценция — воспринимаемое глазом свечение (420—710 нм), присущее многим организмам (бактериям, светлячкам, некоторым рыбам, грибам и простейшим). Во всех случаях биолюминесценция является результатом ферментативного окисления особых веществ— люциферинов, молекулы которых при окислении способны переходить в возбужденное состояние. Фермент, катализирующий окисление люциферинов, получил название люциферазы. Природа люциферина в различных видах организмов может быть различной. Люциферин светлячков по своей природе близок к рибофлавину, а люциферин бактерий — к флавинмононуклеотиду.
В настоящее время люциферин и люцифераза выделены в чистом виде и свечение воспроизведено в растворе. Анализ кинетики реакции показал, что вначале образуется фермент-субстратный комплекс, после чего происходит окисление люциферина молекулярным кислородом. При окислении комплекс переходит в возбужденное состояние и способен испускать квант света.
Сверхслабое свечение, обнаруженное Б. Н. Тарусовым, А. И. Поливодой, А. И. Журавлевым в 1961 г.,— это излучение живых организмов, тканей, клеток, их гомогенатов и некоторых биосубстратов в видимой и инфракрасной области спектра (360—800 нм). Его можно зарегистрировать при помощи специального приемника излучения — фотоэлектронного умножителя с фотометрической установкой, работающей в режиме счетчика фотонов.
Введение объективного метода регистрации позволило установить, что сверхслабое свечение присуще многим реакциям в биологических объектах. Было вы-
85
яснено, что свечение сопровождает окислительные реакции экзотермического характера — в основном реакции цепного типа, развивающиеся по радикальному механизму (см. главу 4). Показано, что интенсивность свечения пропорциональна скорости рекомбинации свободных радикалов. При взаимодействии двух радикалов их неспаренные электроны образуют пару или химическую связь. В процессе образования этой связи, идущей через промежуточное возбужденное состояние, избыток электронной энергии высвечивается в (виде кванта. Эти данные позволили применить метод регистрации свечения для исследования роли возбужденных состояний молекул в различных процессах и для анализа свободнорадикальных реакций. Б. Н. Тарусов и А. И. Журавлев показали, что свечение тканей связано с неферментативным окислением липидов, которое непрерывно протекает в норме во всех тканях и является одним из показателей гомеостаза. Свободнорадикальное окисление оказывает катаболическое действие на организм. Оно определяется, во-первых, конкуренцией свободнорадикального окисления с ферментативным окислением — дыханием, во-вторых, цитотоксическим действием. Продукты свободнорадикального окисления — альдегиды, кетоны, перекиси, радикалы — могут оказывать деструктивное влияние на все системы и структуры клетки.
В организме свободнорадикальное окисление тормозится системой тканевых антиокислителей, в которую входят аскорбиновая кислота, адреналин, сульфгидрильные соединения, каротиноиды, токоферолы и фосфолипиды. Развитие цепного и свободнорадикального окисления в тканях может быть патогенетической основой некоторых заболеваний. При этом сверхслабое свечение тканей может служить диагностическим тестом (А. И. Журавлев, А. И. Журавлева, 1975). Наряду с этим при других заболеваниях изменения интенсивности свечения могут дать дополнительную информацию о нарушении первичных физико-химических процессов в организме.
В последнее время были проведены исследования свечения плазмы и сыворотки крови в условиях стресса и при различных заболеваниях. При стрессе интенсивность свечения плазмы крови увеличивается, что указывает на усиление в крови активности свободнорадикаль-
86
ного окисления. При этом, по мнению А. И. Журавлева, продукты окисления усиливают деструктивные процессы в клетках. За повышенную энергетическую готовность организм расплачивается временным усилением деструктивных процессов.
И. М. Бондарев с соавт. (1972) показали, что воспалительный процесс в легких сопровождается активизацией свободнорадикального окисления и соответствующим повышением уровня свечения сыворотки крови. При этом интенсивность свечения зависит от степени выраженности воспалительного процесса.
Изучение сверхслабого свечения сыворотки крови животных при злокачественных новообразованиях выявило фазные изменения уровня свечения. Сразу после перевивки опухоли и в течение нескольких суток люминесценция заметно усилена. Фаза развития опухоли характеризуется пониженной интенсивностью свечения крови. Исследования на больных людях выявили аналогичную закономерность: уровень свечения сыворотки крови больных злокачественными болезнями оказался пониженным по сравнению со свечением сыворотки крови здоровых людей. В период роста опухоли в ней происходит накопление антиокислителей, транспортируемых кровью из других органов. Повышенное содержание антиокислителей в крови может быть одной из причин снижения интенсивности свечения сыворотки крови. Подавление свободнорадикального окисления в опухоли исключает возможность токсического действия продуктов окисления и тем самым способствует более быстрому росту опухоли. В фазе распада опухоли содержание антиокислителей в сыворотке крови становится ниже, чем в норме. Свечение сыворотки также усиливается по сравнению с нормой.
Таким образом, интенсивность свечения сыворотки крови дает возможность диагностировать три основные фазы развития опухоли как фазы, по-разному влияющие на интенсивность радикального окисления.
Измерение интенсивности хемилюминесценции можно использовать для дифференциальной диагностики заболеваний легких. Изменение интенсивности свечения сыворотки крови туберкулезных и опухолевых животных было противоположно направленным: повышенным у животных с туберкулезом легких и пониженным у животных с перевиваемой опухолью. Аналогичные ре-
87
зультаты были получены при исследовании больных людей. У больных туберкулезом легких независимо от его формы свечение сыворотки крови повышено по сравнению с нормой. У больных раком легкого свечение сыворотки крови оказалось ниже, чем у здоровых лиц.
МИГРАЦИЯ ЭНЕРГИИ
Энергия излучения, поглощенная одной молекулой, может быть передана другой, близко расположенной молекуле. Обычный путь переноса энергии в биологических системах — это диффузия богатых энергией фосфорных соединений, которая осуществляется в растворах. Однако существуют и другие пути переноса энергии. Эти пути — так называемая миграция энергии — имеют особенно важное значение в фотобиологических, радиобиологических и, возможно, в некоторых биохимических процессах. Миграция энергии — это безызлучательная передача энергии от молекулы к молекуле на расстояния, значительно превышающие межатомные, происходящая без растраты в тепло и без кинетических соударений донора и акцептора энергии.
Когда молекула поглощает энергию, то электрон с основного энергетического уровня переходит на более высокий, возбужденный уровень. При движении этих электронов по орбитам в молекуле создается переменное электромагнитное поле. Частота колебаний этого поля определяется энергетическим уровнем возбужденного электрона. Если рядом с возбужденной молекулой находится невозбужденная молекула, которая имеет энергетический уровень, совпадающий или несколько меньший уровня возбужденной молекулы, то возникает явление резонанса. При этом невозбужденная молекула возбуждается, а возбужденная — переходит в невозбужденное состояние, т. е. энергия возбужденной молекулы почти целиком передается невозбужденной молекуле. Это бывает тогда, когда частота испускаемых электромагнитных колебаний донора энергии совпадает с частотой колебаний акцептора энергии. Схематически описанные процессы можно изобразить так:
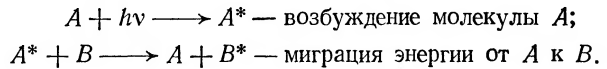
Для возникновения миграции необходимы следующие условия:
88
Донор энергии должен обладать способностью к созданию распространяющегося электромагнитного поля, т. е. способностью к люминесценции.
Частота колебаний электромагнитного поля донора должна совпадать с частотой колебаний акцептора. Для этого необходимо, чтобы спектр люминесценции донора перекрывался со спектром поглощения акцептора.
Необходимо, чтобы донор и акцептор были сближены на достаточное расстояние. Вероятность миграции резко уменьшается при увеличении расстояния между молекулами (вероятность миграции обратно пропорциональна расстоянию между молекулами в шестой степени). Поэтому эффективная миграция происходит, если донор и акцептор достаточно сближены (1—10 нм).
Миграция энергии возбуждения может наблюдаться как по синглетным, так и по триплетным уровням. Направление миграции обусловлено вторым законом термодинамики и всегда соответствует переходу электронов с более высокого уровня в доноре на более низкий в акцепторе.
Наличие миграции определяют с помощью спектральных методов. Если обнаруживается, что вещество, непосредственно не участвующее в фотохимической реакции, начинает люминесцировать (сенсибилизированная люминесценция), то это говорит о наличии миграции энергии, т. е. о том, что молекулы этого вещества получили энергию от других молекул, непосредственно участвующих в поглощении света.
Рассмотренный тип миграции энергии называется резонансным, поскольку он осуществляется в результате резонанса донора и акцептора энергии. Эффективность (вероятность) миграции энергии резонансным способом у белков составляет всего несколько процентов, поэтому данный вид переноса энергии для них существенного значения не имеет. Эффективность резонансной миграции энергии для нуклеиновых кислот достигает 30%. Резонансная миграция энергии может достигать 100% в системах с высокой концентрацией хромофоров —соединений, содержащих систему сопряженных кратных связей.
В некоторых случаях возбужденный электрон может перемещаться от одной молекулы к другой вдоль возбужденного уровня. «Дырка», возникающая после ухо-
89
да электрона, может перемещаться вслед за ним по этому уровню. Такая перемещающаяся пара электрон— «дырка» называется экситоном, а миграция энергии, осуществляющаяся с помощью экситона, называется экситонной миграцией. В отличие от резонансной экситонная миграция энергии может осуществляться на сравнительно большие расстояния.
Экситонная теория была применена при рассмотрении переноса энергии в системах, содержащих биологические пигменты: родопсин, хлорофилл и др. Предполагают, что в процессе фотосинтеза хлоропласты могут функционировать как своеобразные полупроводниковые образования. Поглощение света может приводить к образованию в молекуле хлорофилла свободных электронов и положительных «дырок». Электроны и «дырки» движутся и обусловливают окислительно-восстановительные процессы. Электрон может осуществлять восстановление какого-либо акцептора, так как восстановление — это присоединение молекулой электронов. «Дырка» может осуществлять окисление молекул, так как присоединение «дырки» означает отдачу электрона, т. е. окисление.
ДЕЙСТВИЕ УЛЬТРАФИОЛЕТОВОГО ИЗЛУЧЕНИЯ НА БЕЛКИ И НУКЛЕИНОВЫЕ КИСЛОТЫ
Выяснение механизма действия ультрафиолетового излучения на белки и нуклеиновые кислоты имеет важное общебиологическое значение. С момента возникновения жизни на Земле доклеточные образования и одноклеточные организмы находились под сильным влиянием ультрафиолетового излучения. Под постоянным воздействием ультрафиолетовых лучей находятся живые организмы и в настоящее время. Ультрафиолетовое облучение, приводящее к гибели клеток, появлению мутаций или инактивации клеток, имеет важное практическое значение в медицине, генетике микроорганизмов и т. д. Представляет интерес и проблема стимулирующего действия ультрафиолетового излучения на биологические и ферментативные процессы синтеза веществ.
Спектр ультрафиолетового излучения Солнца разделяют на три области: 1) 180—275 нм — коротковолно-
90
вое излучение. Изменяет структуру белков и липоидов, оказывает бактерицидное действие; 2) 275—320 нм — средневолновое излучение. Оказывает антирахитическое и пигментообразующее действие, усиливает образование эпителия, стимулирует процессы регенерации в организмах; 3) 320—400 нм — длинноволновое излучение. Оказывает слабое биологическое действие, вызывает люминесценцию некоторых органических веществ.
Ультрафиолетовое излучение может вызвать такие фотобиологические реакции, которые приводят к деструкции белков и нуклеиновых кислот. Эти фотобиологические реакции вызывают и вторичные изменения, уже не связанные с непосредственным действием излучения. Первичные изменения состоят в нарушении структуры ДНК и в денатурации белков. Вторичные изменения наступают вследствие того, что клеточные ферменты расщепляют денатурированный белок. При этом накапливаются продукты распада. Продукты распада вызывают раздражение нервных окончаний, которое приводит к сложным рефлекторным реакциям.
Каков же механизм действия ультрафиолетового излучения на белки? При действии излучения на растворы белков наблюдается помутнение раствора, изменение вязкости, изменение скорости оседания в центрифуге, изменение оптического вращения. Короче говоря, появляются все признаки денатурации белка. При денатурации белков, как известно, их ферментативные свойства нарушаются и исчезают. Если облучать биологически активные белки или полипептиды: ферменты, антитела, гормоны, антибиотики, то уже через несколько минут облучения биологическая активность этих веществ резко падает.
Механизм действия ультрафиолетового излучения на белки был раскрыт в основном в работах Ю. А. Владимирова. Поглощение света белками в области 260 — 280 нм обусловлено ароматическими аминокислотами: тирозином и триптофаном. Эти аминокислоты поглощают ультрафиолетовое излучение и разрушаются. Разрушение данных аминокислот приводит к денатурации белков и к инактивации их ферментативной активности. Весь процесс протекает в несколько стадий.
1. Активная стадия — поглощение света и возбуждение молекулы аминокислоты АН:
![]()
91
Этот процесс обратим, т. е. возбужденная молекула может люминесцировать и снова переходить в невозбужденное состояние:
![]()
где, согласно закону Стокса, v1>v2.
С
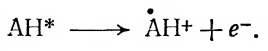 тадия
фотоионизации — возбужденная
молекула
является
неустойчивой и распадается на электрон
и ион-
радикал:
тадия
фотоионизации — возбужденная
молекула
является
неустойчивой и распадается на электрон
и ион-
радикал:
Электрон захватывается другими молекулами, в основном воды, и сольватируется. Ион-радикал является неустойчивым соединением и распадается на свободный радикал и ядро атома водорода (протон):
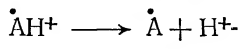
Все эти процессы протекают очень быстро и исследуются с помощью метода импульсной спектрофотометрии при низких температурах.
3. Стадия реакция образовавшихся радикалов и сольватированного электрона. Данная стадия может
и![]() меть
несколько направлений:
меть
несколько направлений:
а) Образовавшийся радикал аминокислоты А взаимодействует с соседними звеньями пептидной цепи белковой молекулы. Это вызывает изменение конфигурации белковой молекулы. Так как радикалы в химическом отношении очень активны, то образовавшаяся связь бывает прочной, и нарушенная конфигурация белковой молекулы закрепляется. Нарушение конфигурации молекулы (изменение третичной и вторичной структуры) уже на этом этапе приводит к инактивации ферментативных свойств, особенно в связи с тем, что ароматические аминокислоты часто входят в состав активных центров ферментов.
б) Свободный радикал аминокислоты может взаимодействовать с кислородом и образовывать перекисный радикал аминокислоты:

в) Сольватированный электрон является исключительно сильным восстановителем. Ион водорода — протон — также в химическом отношении очень активен.
92
Они взаимодействуют с аминокислотными остатками белковой молекулы. При этом образуются аммиак и радикалы аминокислот:
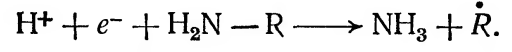
В результате этого процесса происходит разрушение звеньев белковой молекулы.
4. Стадия образования устойчивых продуктов окисления. Все образовавшиеся радикалы аминокислот взаимодействуют с различными веществами. Через цикл реакций, которые пока еще слабо изучены, образуются устойчивые продукты окисления. Эти образовавшиеся продукты обладают токсическими свойствами. Они взаимодействуют с молекулами белка и также нарушают их структуру.
В ультрафиолетовой области спектра (260 нм) сильно поглощают лучи только азотистые основания нуклеиновых кислот. По этой причине именно они подвергаются фотохимическим превращениям при ультрафиолетовом облучении. Наиболее важные реакции, идущие под действием ультрафиолетового излучения, это фотохимическое окисление, фотохимическое гидрирование (присоединение молекул воды к азотистым основаниям) и фотодимеризация. Фотодимеризация заключается в образовании устойчивой химической связи между двумя азотистыми основаниями под действием фотонов. При большой дозе ультрафиолетового облучения может происходить разрыв колец азотистых оснований.
Основное действие ультрафиолетовых лучей на нуклеиновую кислоту заключается в том, что последняя теряет биологическую активность, т. е. способность передавать заключенную в ней информацию. При этом основную роль в инактивации ДНК играют процессы димеризации тиминовых оснований. Процессы димеризации тиминовых оснований протекают раньше других фотохимических реакций. Когда еще не наблюдается заметного накопления гидрированных и окисленных оснований, инактивация ДНК уже происходит. Две молекулы тимина в двойной спирали ДНК никогда не расположены рядом. Более того, в силу комплементарное™ нитей в ДНК они никогда не расположены точно напротив друг друга. Под воздействием ультрафиолетовых лучей возникает местное расплетение нитей ДНК. Затем нити изгибаются таким образом, что тиминовые
93
основания сближаются. Между ними возникает стойкая химическая связь, которая как бы стягивает двойную нить ДНК и препятствует считыванию с нее информации.
Ультрафиолетовое излучение оказывает сильное бактериостатическое и бактерицидное действие. При облучении ультрафиолетовыми лучами бактерий и вирусов происходит угнетение их активности, подавление способности к размножению и гибель. Механизм действия ультрафиолетового излучения на бактерии и вирусы был выявлен при изучении спектров действия инактивации этих организмов. Под спектром действия понимают зависимость величины фотобиологического эффекта от длины волны излучения. Оказалось, что спектр действия инактивации при ультрафиолетовом облучении вирусов и бактерий совпадает со спектром поглощения нуклеиновых кислот (У. Винклер, 1962). Следовательно, основой бактерицидного действия ультрафиолетовых лучей является повреждение и инактивация нуклеиновых кислот. Для бактерий, кроме того, определенное значение имеет и повреждение ферментных систем.
Другая картина была получена при исследовании влияния ультрафиолетовых лучей на клетки млекопитающих. Для них излучения с длиной волны 260 и 280 нм обладают почти одинаковой эффективностью. Это указывает на то, что в клетках млекопитающих фотохимическое повреждение белков так же существенно, как и повреждение ДНК (И. П. Арман, 1971).
Бактерицидное действие ультрафиолетового излучения широко используется в лечебных и профилактических целях, для облучения участков тела, содержащих инфекцию, для стерилизации различных предметов, веществ, продуктов питания и т. п.
Вредное влияние на организм человека оказывают лишь большие дозы облучения коротковолновыми лучами. Умеренные дозы ультрафиолетового облучения повышают общую и иммунную реактивность организма, что позволяет применять ультрафиолетовые лучи с лечебными и профилактическими целями. Особое значение ультрафиолетовое облучение имеет в процессе образования витамина D из 7,8-дегидрохолестерина и эргостерина. Облучение кожи вызывает разрыв двойной связи в кольце, что приводит к проявлению антирахи-
94
тических свойств этого витамина. Длительное пребывание в условиях, исключающих ультрафиолетовое облучение, приводит к подавлению синтеза витамина D и к развитию нарушений фосфорно-кальциевого обмена.
