
- •Теоретические основы
- •1Химическая кинетика
- •1.1Скорость химической реакции
- •1.2Константа скорости
- •1.3Основные кинетические уравнения химических реакций различных порядков
- •1.4Методы определения порядка химических реакций
- •2Катализ химических реакций
- •2.1Каталитический метод ускорения реакций и виды катализа
- •2.2Гомогенный и гетерогенный катализ
- •Лабораторная работа 1 исследование кинетики реакции йодирования ацетона
- •3Оборудование. Материалы
- •4Ход работы
- •4.1Проведение эксперимента
- •4.2Обработка экспериментальных данных.
- •Лабораторная работа 2 кинетика химических реакций. Определение константы омыления сложного эфира
- •5Оборудование. Материалы
- •6Ход работы
- •6.1Проведение эксперимента
- •6.2Обработка результатов
- •Лабораторная работа 3 изучение скорости разложения мурексида в кислой среде
- •7Оборудование. Материалы
- •8Ход работы
- •8.1Проведение эксперимента
- •8.2Обработка результатов
- •Лабораторная работа 4 изучение кинетики реакции каталитического разложения пероксида водорода
- •9Оборудование. Материалы
- •10Ход работы
- •10.1Подготовка лабораторной установки к работе
- •Соединить бюретку 9 с атмосферой, переводом крана 8 в положение 17. При этом реакционная колба 3 изолируется от атмосферы.
- •10.2Измерение скорости каталитического разложения пероксида водорода
- •10.3Обработка экспериментальных данных
- •Лабораторная работа 5 влияние массы катализатора на скорость химической реакции при гетерогенном катализе
- •11Оборудование. Материалы
- •12Ход работы
- •12.1Установка концентрации исходного раствора пероксида водорода
- •12.2Подготовка лабораторной установки к работе
- •Поворотом крана 8 соединить бюретку 9 с атмосферой (положение 17). При этом реакционная колба 3 изолируется от атмосферы.
- •12.3Измерение скорости каталитического разложения перекиси водорода
- •12.4Обработка экспериментальных данных
- •Вопросы для самоконтроля
- •Литература Список основной литературы
- •Дополнительная литература
- •357108, Г. Невинномысск, ул. Гагарина, 1
8.2Обработка результатов
По экспериментальным данным (таблица 4.1) рассчитать константу скорости химической реакции разложения мурексида в HCl-среде для каждого значения времени I по формуле:
![]() ,
,
где D0 – оптическая плотность реакционной смеси в момент сливания;
D – оптическая плотность реакционной смеси через время от начала реакции;
– время от начала реакции, с.
Для 2-х температур и 2-х объёмов добавленной HCl рассчитать средние значения констант скорости реакции:
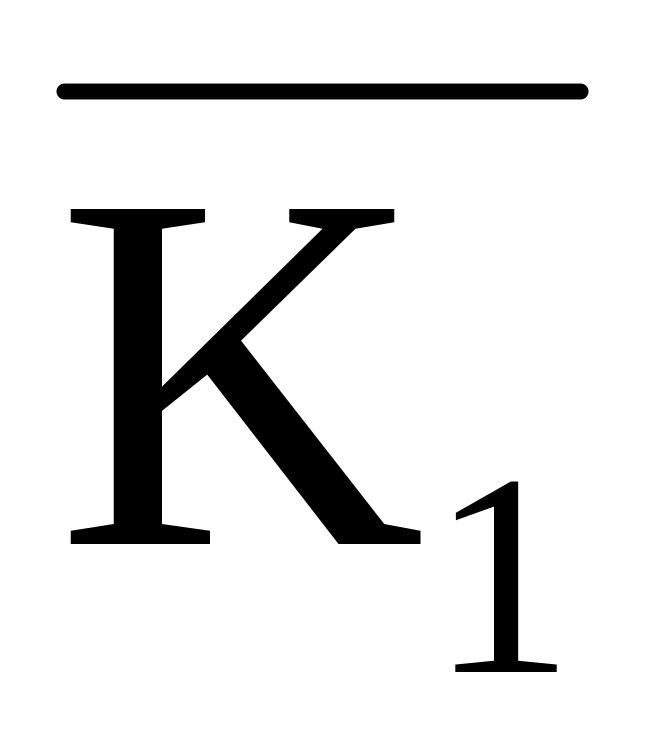 и
и
 .
.Рассчитать энергию активации реакции разложения мурексида по формуле:
![]() .
.
Рассчитать энтропию активации для T1 и T2 по формуле:
![]() .
.
Результаты расчетов занести в таблицу 4.2.
Таблица 4.2 – Результаты расчетов кинетики реакции разложения мурексида
Комнатная температура |
Температура термостата |
Энергия активации, Е |
Энтропия активации, ΔS |
|||||||
Время колорим. (мин) |
Константа скорости реакции |
Константа скорости реакции |
||||||||
V (HCl)= 10 см3 |
V (HCl)= 7 см3 |
V (HCl)= 10 см3 |
V (HCl)= 7 см3 |
|||||||
Кi |
|
Кi |
|
Кi |
|
Кi |
|
|||
0 |
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
||||||
20 |
|
|
|
|
||||||
30 |
|
|
|
|
||||||
40 |
|
|
|
|
||||||
50 |
|
|
|
|
||||||
60 |
|
|
|
|
||||||
Сделать вывод о проделанной работе.
Лабораторная работа 4 изучение кинетики реакции каталитического разложения пероксида водорода
Цель работы: 1. Изучить процесс каталитического разложения пероксида водорода.
2.Рассчитать константу скорости реакции каталитического разложения пероксида водорода.
3.Определить кинетический порядок реакции разложения пероксида водорода.
Исследуемая реакция:
2Н2О2 = 2Н2О + О2↑ (1)
