
- •Теоретические основы
- •1Химическая кинетика
- •1.1Скорость химической реакции
- •1.2Константа скорости
- •1.3Основные кинетические уравнения химических реакций различных порядков
- •1.4Методы определения порядка химических реакций
- •2Катализ химических реакций
- •2.1Каталитический метод ускорения реакций и виды катализа
- •2.2Гомогенный и гетерогенный катализ
- •Лабораторная работа 1 исследование кинетики реакции йодирования ацетона
- •3Оборудование. Материалы
- •4Ход работы
- •4.1Проведение эксперимента
- •4.2Обработка экспериментальных данных.
- •Лабораторная работа 2 кинетика химических реакций. Определение константы омыления сложного эфира
- •5Оборудование. Материалы
- •6Ход работы
- •6.1Проведение эксперимента
- •6.2Обработка результатов
- •Лабораторная работа 3 изучение скорости разложения мурексида в кислой среде
- •7Оборудование. Материалы
- •8Ход работы
- •8.1Проведение эксперимента
- •8.2Обработка результатов
- •Лабораторная работа 4 изучение кинетики реакции каталитического разложения пероксида водорода
- •9Оборудование. Материалы
- •10Ход работы
- •10.1Подготовка лабораторной установки к работе
- •Соединить бюретку 9 с атмосферой, переводом крана 8 в положение 17. При этом реакционная колба 3 изолируется от атмосферы.
- •10.2Измерение скорости каталитического разложения пероксида водорода
- •10.3Обработка экспериментальных данных
- •Лабораторная работа 5 влияние массы катализатора на скорость химической реакции при гетерогенном катализе
- •11Оборудование. Материалы
- •12Ход работы
- •12.1Установка концентрации исходного раствора пероксида водорода
- •12.2Подготовка лабораторной установки к работе
- •Поворотом крана 8 соединить бюретку 9 с атмосферой (положение 17). При этом реакционная колба 3 изолируется от атмосферы.
- •12.3Измерение скорости каталитического разложения перекиси водорода
- •12.4Обработка экспериментальных данных
- •Вопросы для самоконтроля
- •Литература Список основной литературы
- •Дополнительная литература
- •357108, Г. Невинномысск, ул. Гагарина, 1
6.2Обработка результатов
Рассчитать объем соляной кислоты V0, идущей на нейтрализацию NaOH в пробе до начала реакции в момент = 0 по формуле:
![]() ;
;
где C(NaOH), C(HCl) – рабочие концентрации растворов HCl и NaOH; моль/дм3;
K(NaOH), K(HCl) – поправочные коэффициенты;
Vаликв – объем аликвоты реакционной смеси, см3.
Рассчитать значения константы скорости реакции омыления этилацетата по основным кинетическим уравнениям различных порядков:
![]() ,
,
![]() ,
,
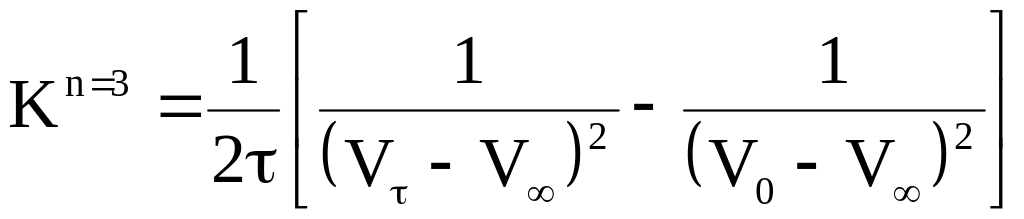 .
.
По результатам расчета выбрать порядок реакции (n=1; 2; 3) при котором константа скорости реакции К показывает наименьший разброс значений.
Построить графически зависимости объёмов VI от времени реакции.
Сделать вывод о проделанной работе.
Лабораторная работа 3 изучение скорости разложения мурексида в кислой среде
Цель работы: 1 Определение среднего значения константы скорости разложения мурексида в кислой среде и при двух заданных температурах.
2 Расчёт энергии активации и энтропии активации.
Исследуемая реакция:
В кислой среде мурексид (аммонийная соль пурпуровой кислоты) разлагается на урамил и аллоксан:
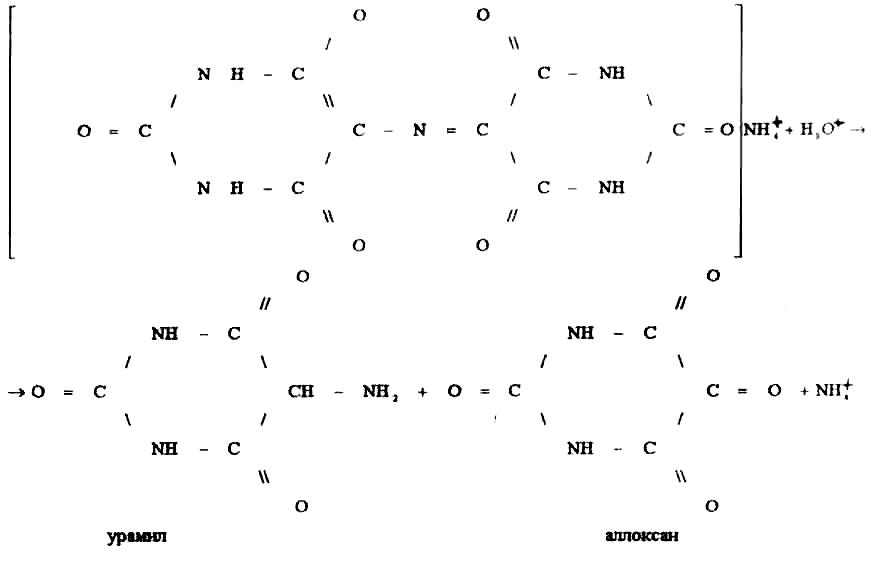
Урамил Аллоксан
7Оборудование. Материалы
Термостат.
Фотоэлектроколориметр КФО.
Раствор HCl c C(HCl) = 0,02 моль/дм3.
Пипетки V = 20; 50 см3.
конические колбы V = 250 см3, 4 шт.
Водный раствор 0,016%-ного мурексида
Кюветы кварцевые 1= 10мм, 2 шт.
8Ход работы
8.1Проведение эксперимента
Включить термостат за 30-40 минут до начала работы. Задать контактным термометром температуру 35-36 0С.
Через 20 минут поместить в термостат: а) раствор 0,016%-ного мурексида в мерной колбе ёмкостью 500 см3; б) раствор HCl с концентрацией C(HCl) = 0,02 моль/дм3 в мерной колбе ёмкостью 100 см3. Оба раствора оставить в термостате на 30 минут.
Включить Фотоэлектроколориметр КФО за 30-40 минут до начала работы.
Провести реакцию разложения мурексида в кислой среде при комнатной температуре (зафиксировать температуру). Для этого:
4.1 В 2 конические колбы ёмкостью 250 см3 отобрать пипетками по 90 см3 водного раствора 0,016%-ного мурексида.
4.2 В колбу №1 с раствором марексида добавить 10 см3 раствора HCl C(HCl) = 0,02 моль/дм3; в колбу №2 с мурексидом – добавить 7 см3 раствора HCl. Зафиксировать время сливания растворов мурексида и HCl.
4.3 Измерить оптическую плотность D0 полученных при сливании растворов в кювете толщиной 10 мм со светофильтром №2 (зелёный) в соответствии с методическими указаниями по работе на КФО. Результаты измерений оптической плотности D занести в таблицу 4.1.
Таблица 4.1 – Экспериментальные данные кинетики реакции разложения мурексида
Комнатная температура |
Температура термостата |
|||||||
Время колорим. (мин) |
Объём добавленного раствора HCl |
Объём добавленного раствора HCl |
||||||
V (HCl)= 10 см3 |
V (HCl)= 7 см3 |
V (HCl)= 10 см3 |
V (HCl)= 7 см3 |
|||||
Опт плотн Di |
Опт плотн
|
Опт плотн Di |
Опт плотн
|
Опт плотн Di |
Опт плотн
|
Опт плотн Di |
Опт плотн
|
|
0 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
||||
20 |
|
|
|
|
||||
30 |
|
|
|
|
||||
40 |
|
|
|
|
||||
50 |
|
|
|
|
||||
60 |
|
|
|
|
||||
4.4 Проводить измерения оптической плотности D реакционной смеси (мурексид + HCl) через каждые 10 минут, отливая реакционную смесь из конической колбы в фотометрическую кювету толщиной 10 мм с предварительным ополаскиванием кюветы реакционной смесью.
4.5 Измерения оптической плотности проводить до обесцвечивания реакционной смеси.
Провести реакцию разложения мурексида в кислой среде при повышенной температуре t = 35 – 36 0С. Для этого:
5.1 В 2 конические колбы (3 и 4) ёмкостью 250 см3 отобрать пипетками по 90 см3 водного раствора 0,016%-ного мурексида из термостата (отбирать быстро!).
5.2 В колбу 3 с раствором мурексида добавить 10 см3 раствора HCl C(HCl) = 0,02 моль/дм3; в колбу №2 с мурексидом – добавить 7 см3 раствора HCl из термостата. Зафиксировать время сливания термостатированных растворов мурексида и HCl.
5.3 Измерить оптическую плотность D0 полученных при сливании растворов в колбах 3 и 4, в кювете толщиной 10 мм со светофильтром №2 (зелёный). Результаты измерений оптической плотности D занести в таблицу 4.1.
5.4 Проводить измерения оптической плотности D термостатированной реакционной смеси (мурексид + HCl) через каждые 10 минут, отливая реакционную смесь из конической колбы в фотометрическую кювету толщиной 10 мм с предварительным ополаскиванием кюветы реакционной смесью.
5.5 Измерения оптической плотности проводить до обесцвечивания реакционной смеси в термостате.
5.6 Результаты измерений оптической плотности при проведении реакции разложения мурексида в кислой среде при повышенной температуре t = 35 – 36 0С занести в таблицу 4.1.
