
- •Теоретические основы
- •1Химическая кинетика
- •1.1Скорость химической реакции
- •1.2Константа скорости
- •1.3Основные кинетические уравнения химических реакций различных порядков
- •1.4Методы определения порядка химических реакций
- •2Катализ химических реакций
- •2.1Каталитический метод ускорения реакций и виды катализа
- •2.2Гомогенный и гетерогенный катализ
- •Лабораторная работа 1 исследование кинетики реакции йодирования ацетона
- •3Оборудование. Материалы
- •4Ход работы
- •4.1Проведение эксперимента
- •4.2Обработка экспериментальных данных.
- •Лабораторная работа 2 кинетика химических реакций. Определение константы омыления сложного эфира
- •5Оборудование. Материалы
- •6Ход работы
- •6.1Проведение эксперимента
- •6.2Обработка результатов
- •Лабораторная работа 3 изучение скорости разложения мурексида в кислой среде
- •7Оборудование. Материалы
- •8Ход работы
- •8.1Проведение эксперимента
- •8.2Обработка результатов
- •Лабораторная работа 4 изучение кинетики реакции каталитического разложения пероксида водорода
- •9Оборудование. Материалы
- •10Ход работы
- •10.1Подготовка лабораторной установки к работе
- •Соединить бюретку 9 с атмосферой, переводом крана 8 в положение 17. При этом реакционная колба 3 изолируется от атмосферы.
- •10.2Измерение скорости каталитического разложения пероксида водорода
- •10.3Обработка экспериментальных данных
- •Лабораторная работа 5 влияние массы катализатора на скорость химической реакции при гетерогенном катализе
- •11Оборудование. Материалы
- •12Ход работы
- •12.1Установка концентрации исходного раствора пероксида водорода
- •12.2Подготовка лабораторной установки к работе
- •Поворотом крана 8 соединить бюретку 9 с атмосферой (положение 17). При этом реакционная колба 3 изолируется от атмосферы.
- •12.3Измерение скорости каталитического разложения перекиси водорода
- •12.4Обработка экспериментальных данных
- •Вопросы для самоконтроля
- •Литература Список основной литературы
- •Дополнительная литература
- •357108, Г. Невинномысск, ул. Гагарина, 1
4.2Обработка экспериментальных данных.
Рассчитать объем сернистоватистокислого натрия Na2S2O3 – V0, пошедшего на оттитровывание иода в пробе до начала реакции в момент = 0 по формуле:
![]() ,
см3
,
см3
где С(1/2 J2), C(Na2S2O3) – рабочие концентрации растворов J2 и Na2S2O3, моль/дм3 ;
K(J2), K(Na2S2O3) – поправочные коэффициенты;
Vаликв – объем аликвоты реакционной смеси, см3.
Рассчитать значение константы скорости реакции иодирования ацетона по основным кинетическим уравнениям различных порядков:
![]() ,
,
![]() ,
,
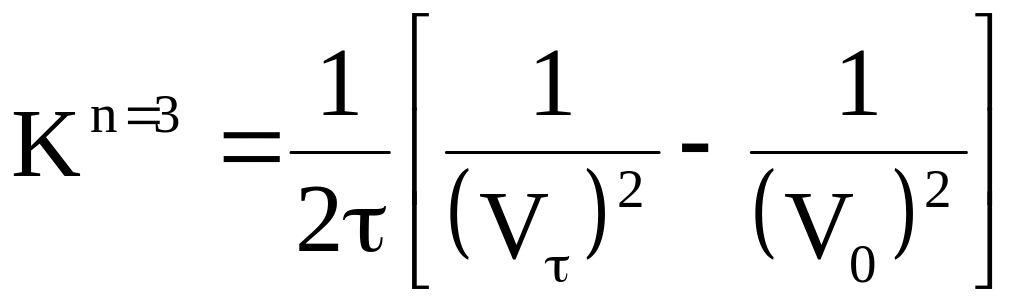 .
.
Результаты расчета занести в таблицу 2.2. По результатам расчета выбрать порядок реакции (n = 1, 2, 3), при которой константа скорости К показывает наименьший разброс значений.
Построить графические зависимости для реакций различных порядках в координатах:

Установить порядок реакции иодирования ацетона в кислой среде сравнением результатов расчетных данных по п.2 и графических зависимостей по п.3 Реакции иодирования ацетона в кислой среде присваивается тот порядок, при котором расчетные значения константы скорости химической реакции по п.2 имеют наименьший разброс и прямолинейную графическую зависимость в указанных по п.3 координатах.
Рассчитать среднее значение
 скорости реакции омыления этилацетата
для установленного порядка реакции:
скорости реакции омыления этилацетата
для установленного порядка реакции:
![]() ,
,
где ni – число рассчитанных значений K скорости реакции.
Таблица 2.3 – Расчетные данные
№ |
Константа скорости |
||
n=1 |
n=2 |
n=3 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
|
|
|
|
6. Сделать вывод по проведению работы.
Лабораторная работа 2 кинетика химических реакций. Определение константы омыления сложного эфира
Цель работы: 1 Определение кинетического порядка реакции.
2 Определение константы омыления сложного эфира.
Исследуемая реакция:
CH3COOC2H5 + H2O C2H5OH + CH3COOH
5Оборудование. Материалы
Уксусноэтиловый эфир (этилацетат) ГОСТ – раствор с концентрацией C(С4H8O2) = 0,02 моль/дм3.
Едкий натр NaOH по ГОСТ – раствор с С(NaOH) = 0,03 моль/дм3.
Соляная кислота HCl (ρ=1,19 г/см3) по ГОСТ – раствор с C(HCl) = 0,03 моль/дм3.
Фенолфталеин, индикатор, 1%-ный раствор по ГОСТ.
Электроплитка.
Термостат.
Секундомер.
Термометры с ценой деления 0,1 0С.
Пипетка градуированная, объемом V = 2 см3 и 5 см3 по ГОСТ.
Бюретки объемом V = 25 см3 по ГОСТ.
Колбы мерные объемом 1000 см3 и 250 см3 500 см3 по ГОСТ.
Воронка стеклянная диаметром D = 70 и D = 35 мм по ГОСТ.
Стаканы химические объемом V = 50 см3 и V = 250 см3 по ГОСТ.
Колбы конические объемом 100 см3 по ГОСТ.
Асбестовое полотно.
Лабораторная мешалка.
