
- •Волновые свойства электронов
- •Взаимодействие электронов с веществом
- •Принципиальная схема микроскопа
- •Электромагнитные линзы
- •Передача информации от образца к изображению
- •Просвечивающие и сканирующие микроскопы
- •Системы регистрации изображения
- •Подложки
- •Тонкие срезы
- •Контрастирование
- •Криомикроскопия
- •Иммуноэлектронная микроскопия
- •Применение золотых кластеров
- •II. Микроскопия силового поля
- •Принципы сканируюшей туннельной и атомно-силовой микроскопии
- •Атомно силовой микроскоп
- •Способы получения изображения
- •Основной принцип работы асм
- •Визуализация биологических структур
- •Подложки и приготовление образцов
- •III. Флуоресцентная микроскопия
- •Стандартный флуоресцентный микроскоп
- •Двух- и трехфотонное возбуждение
Подложки
В прошлом подложки изготавливали наложением на медные сетки пластика (обычно формвар), а поверх них - углеродной пленки. Затем сетки обрабатывали тлеющим разрядом для приведения их в гидрофильное состояние.
В настоящее время используют готовые сетки с дырчатой плёнкой-подложкой (“Holey-film”, “microgrid”) и тонкой углеродной плёнкой сверху (Рис. Ж1.8). Это позволяет существенно снизить уровень шума на образце и тем самым повысить разрешение.
Обычно образец укрепляется на углеродной пленке, которая помещается на ЭМ-сетку. В дырчатой плёнке-подложке имеются многочисленные отверстия, достаточно маленькие, чтобы образец мог сформировать тонкую пленку на поверхности, перекрывая отверстия сетки. В процессе получения изображения препарат можно наклонять по отношению к электронному пучку с помощью предметного столика, укрепленного на гониометре.

Рис. Ж1.8. Общий вид сетки для электронной микроскопии. Сетки G400, например, имеют 400 ячеек на квадратный дюйм
Тонкие срезы
В методе тонких срезов, который заимствован у гистологов, образец заключается в полимер (обычно эпоксисмолы), который затем разрезают ультрамикротомом получая тонкие срезы. Вначале образец фиксируют для сохранения его структуры. Для этого его обычно обрабатывают 1%-м раствором глутаральдегида или формальдегида. Если материал используется только для морфологических исследований, то после окончания первого этапа фиксации образцы обрабатываются тетраоксидом осмия (ОsO4, 254 Да) для окончательной фиксации и увеличения контраста между отдельными компонентами образца. После этого исследуемые образцы обрабатываются растворами тяжелых металлов (чаще всего уранилацетат) для неспецифического увеличения контраста.
Современный ультрамикротом представляет серьезное инженерное сооружение, с помощью которого можно получать срезы разной толщины от 20 нм до 2 мкм.
Контрастирование
Принципы контрастирования образцов
Основные элементы, из которых состоят биологические молекулы (кислород, углерод и азот), имеют небольшую электронную плотность, и потому слабо взаимодействуют с электронным пучком. Контрастирование (окрашивание) с применением тяжелых металлов широко применяется при изучении биологических образцов. Это простой и быстрый метод для определения общей морфологии макромолекул, приводящий к получению высококонтрастных изображений с разрешением около 15 Ǻ. Образец окрашивается позитивно или негативно путем погружения его в электронно-плотную среду, такую как соли урана. На электронной микрофотографии образец проявляется как светлая область на темном фоне – негативное контрастирование, или, наоборот как тёмная область на светлом фоне – позитивное контрастирование. Следует отметить, что в этих случаях, анализируется не собственно частица, а распределение краски вокруг и внутри неё. Сама частица неразличима. Благодаря высокому амплитудному контрасту, окрашенные образцы могут быть зарегистрированы при минимальном уровне расфокусировки.

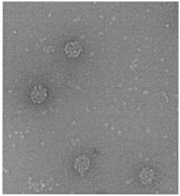
Рис. Ж1.9. (a) Схема, показывающая как электронно-плотный материал покрывает биологический образец. (б) Пример фотографии негативно окрашенного вируса
К сожалению, в процессе приготовления образца этим методом, могут возникать многочисленные артефакты: деформация при высушивании; искажение структуры при взаимодействии с тяжелыми металлами, низким рН и др. Тем не менее, опубликовано огромное число работ, где показано, что удаётся сохранить структуру исследуемого объекта близкой к нативной. Окрашивание позволяет, например, отчетливо отображать симметричное строение вирусов (Рис. Ж1.9б) и строение 70S рибосомных частиц. (Рис. Ж1.10) На негативно контрастированных иммуноглобулинах (IgG) свиньи хорошо различимы не только Fab и Fc части, но также деление Fab на вариабельную и константную части; домены; положение углеводной компоненты (Рис. Ж1.11).


Рис. Ж1.10. Примеры фотографии 70S рибосомных частиц (а и б) и их моделей в двух проекциях (в и г). Малая (30S) и большая (50S) показаны желтым и красным, соответственно. Фотографии любезно предоставлены В.Д. Васильевым

Рис Ж1.11. Иммуноглобулин G свиньи (поздний, непреципитирующий). Негативное контрастирование уранил-ацетатом. Чётко видно разделение молекулы на Fab- и Fc- субъединицы а также деление на домены: 1- вариабельный (VL-VH); 2- константный (CL, CH1 ); 3- константный (CH2- CH2); 4- константный (CH3 , CH3). Видно и то, что CH2 домены тесно взаимодействуют друг с другом, а CH3, наоборот, не имеют тесного взаимодействия. Шарнирный участок находится в компактной конформации (5) и соединяет Fab и Fc. Также виден полисахаридный компонент как электронно-плотная область (6). Фотография любезно предоставлена С. Рязанцевым
Методика негативного окрашивания
В методике негативного контрастирования небольшое количество образца наносят пипеткой на покрытую углеродом сторону сетки и дают ему растечься. После этого сетку несколько раз быстро окунают в буфер, чтобы удалить излишки образца, а потом – на короткое время (несколько секунд или, если надо, дольше) в раствор контрастирующего вещества (например, уранилацетата). После этого фильтровальной бумагой удаляют лишнюю жидкость и сушат сетку на воздухе.
