
- •58 Лекция 14. Масс-спектрометрия лекция 14. Масс-спектрометрия Что такое масс-спектрометрия?
- •Ионы в электрическом и магнитном полях Масса и заряд
- •Ионы в электромагнитном поле. Закон Лоренца
- •Разрешающая способность масс-спектрометрии
- •Точность измерения массы
- •Методы ионизации
- •От ионов в растворе к ионам в газовой фазе
- •Электронная ионизация
- •Ионизация полем
- •Бомбардировка быстрыми атомами
- •Плазменная десорбция
- •Ионизация лазерной десорбцией при помощи матрицы
- •Химическая ионизация при атмосферном давлении
- •Фотонная ионизация при атмосферном давлении
- •Ионизация лазерной десорбцией с поверхности кремния
- •Ионизация электрораспылением
- •Наноэлектрораспыление
- •Сравнение возможностей различных методов образования ионов
- •Масс-спектрометры Общая архитектура масс-спектрометра
- •Чувствительность
- •Динамический диапазон
- •Вакуумирование
- •Различные типы масс-анализаторов
- •Масс-спектрометры с одиночной и двойной фокусировкой
- •Квадрупольный масс-фильтр
- •Kвадрупольная ионная ловушка
- •Масс-спектрометрия с фурье-преобразованием
- •Времяпролетная масс-спектрометрия
- •Детекторы
- •Тандемная масс-спектрометрия
- •Орбитальная ловушка ионов
- •Масс-спектры биологических макромолекул Представление масс-спектра вещества и его интерпретация
- •Масс-спектры простых соединений
- •Масс-спектры биологических макромолекул
- •Нуклеиновые кислоты
- •Карбогидраты
Масс-спектры биологических макромолекул Представление масс-спектра вещества и его интерпретация
Масс-спектр вещества обычно представляется в виде вертикальных отрезков, каждый из которых представляет ион, имеющий определенное отношение массы к заряду m/z (положение на оси абсцисс) и величину, которая указывает на относительную встречаемость иона в образце (ордината I спектра) (рис. 9.1).
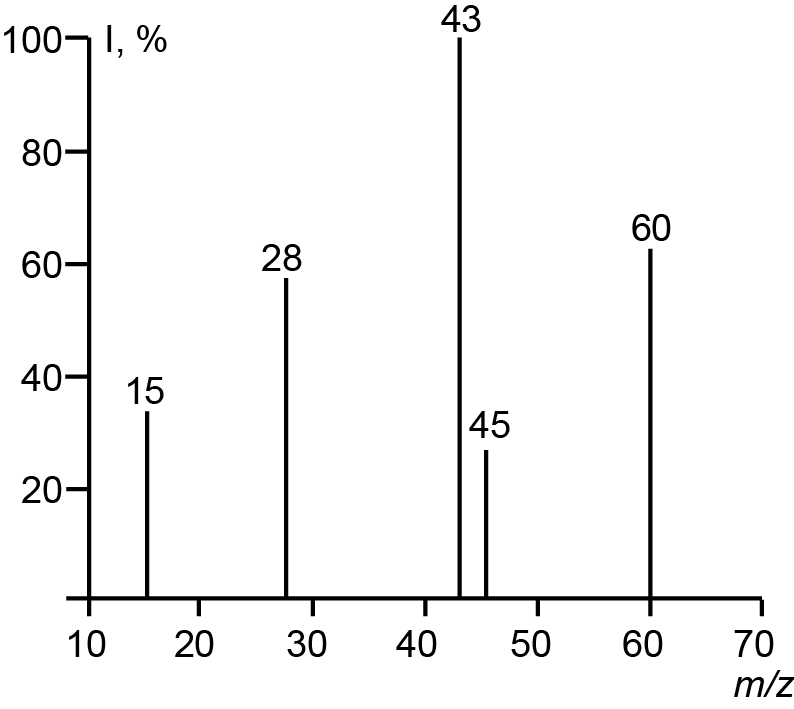
Рис. 9.1. Пример масс-спектра простого соединения в графическом виде
Наиболее интенсивный пик обычно имеет встречаемость равную 100% и считается основным пиком. Наибольшая величина отрезка (наибольшая масса) обычно ассоциируется с молекулярным ионом, тогда как меньшие массы ассоциируются с его фрагментами. Если ионы в масс-спектре имеют заряд равный единице, то положения их пиков эквивалентны их массам.
Интерпретация масс-спектра
Опишем несколько простых правил расшифровки масс-спектров.
Спектры обычно расшифровывают от большего отношения m/z к меньшему, поскольку крупные фрагменты обычно наиболее информативны. Для них возможно лишь весьма ограниченное число путей образования, тогда как мелкие могут возникать самыми разными путями и извлечь аналитически полезную информацию о них из спектра гораздо труднее.
Молекулярный ион
Начинать интерпретацию спектра следует с установления пика молекулярного иона, т.е. пика, соответствующего ионизированной, но не распавшейся исходной молекулы. Обычно его обозначают буквой М. Относительная интенсивность пика М позволяет сделать определенные предположения о его структуре и принадлежности анализируемого соединения к тому или иному классу. Масса M равна массе ионизируемой молекулы, за вычетом массы одного электрона. Вероятность образования молекулярного иона больше для малых простых молекул. С ростом числа атомов в молекулах растет вероятность фрагментации иона М+. Такие устойчивые группы как бензольное кольцо наоборот, способствуют образованию молекулярного иона. На самом деле молекулярные массы могут иметь только дискретные значения, что сразу резко ограничивает число возможных структур, а более подробный анализ спектра в области пика молекулярного иона позволяет получить еще целый ряд дополнительных сведений. Приведем простой пример. Природный бром состоит из двух изотопов 79Br и 81Br в соотношении 1:1. Поэтому молекулярный ион любого соединения, содержащего один атом брома, дает в масс-спектре два пика равной интенсивности, различающиеся на две атомных единицы массы. Такой дуплет в спектре весьма характерен и сразу указывает на наличие в анализируемом соединении только одного атома брома. А если бы в нем было два атома брома, то соответствующие ионы дали бы пик в виде триплета с расстоянием между компонентами в две единицы массы и соотношением интенсивностей 1:2:1.
Однако при выборе пика молекулярного иона следует помнить, что уменьшение М на величину от 5 до 14 или от 21 до 25 а.е.м., приводящее к возникновению интенсивных пиков ионов, крайне маловероятны. Если в спектре такие пики все же присутствуют, то наиболее интенсивный пик М взятый в качестве молекулярного, по-видимому, выбран неверно или в образце имеются примеси. Например, если в масс-спектре чистого соединения самый тяжелый ион имеет массу 120, а следующий за ним – 112, ион 120 – не молекулярный, а фрагментарный. Кроме того, если интенсивность пика М+2 составляет менее 3% от интенсивности пика М, то соединение не содержит атомов хлора, брома, серы и кремния, что связано с природой изотопов этих элементов.
Далее анализируем фрагменты. Молекулярный ион распадается на две частицы: заряженную и нейтральную. Последняя часто оказывается высокоустойчивой малой молекулой типа H2O, CO и т.п. Эти фрагменты нейтральны, однако их можно идентифицировать косвенно – по разности масс молекулярного иона и заряженного фрагмента. Последние часто описывают как разности, например: M-H2O, или M-18; M-CO, или M-28; M-CH3, или M-15; M-H2C=C=O, или М-42 и т.д. Состав таких больших фрагментов обычно легко идентифицировать, так как число вариантов состава малых фрагментов весьма невелико. Так, например, для обычных органических соединений М-18 – это всегда M-H2O. А интенсивный сигнал иона М - Н (М-1) означает не только наличие лабильного атома водорода, но и отсутствие других лабильных групп в этом положении. В области высоких масс важны практически все пики, даже если их интенсивность ниже 1%. Фрагментов, которые возникают непосредственно за распадом молекулярного иона, может быть несколько, так как распад может протекать по нескольким направлениям.
Первичные фрагменты, в свою очередь, подвергаются дальнейшему распаду. Так возникают серии ионов, отвечающих определенным путям распада, или, как чаще говорят, фрагментации молекулярного иона.
Фрагментация молекулярного иона.
Фрагментация молекулярного иона может идти в разных направлениях, обусловленных строением молекулы и методом ионизации. Процесс ионизации не является простым удалением электрона у одной из связей. В действительности, возникший заряд настолько быстро перераспределяется по связям, что при ионизации происходит одновременное ослабление всех связей, но одна из связей может ослабляться в большей степени, чем другие. С ростом энергии ионизирующих агентов вначале рвутся самые слабые связи, а при больших энергиях возрастают вероятности разрыва более прочных связей, и появляются всевозможные осколочные ионы. Количественной характеристикой осколочных ионов является их потенциал появления, т.е. минимальная энергия ионизирующего агента, которой достаточно для образования соответствующего осколочного иона. Наличие осколочных ионов, наряду с молекулярными и другими ионами, делает масс-спектр характеристичным для данного вещества. Виды осколочных ионов, их относительные интенсивности приводятся в специальных каталогах или атласах масс-спектров, которые используются для идентификации анализируемых веществ.
Многие вещества дают перегруппировочные ионы, происхождение которых не может быть объяснено простым разрывом связей в молекулярном ионе, т.е. они возникают в результате перегруппировки атомов в момент диссоциации. Это означает, что фрагментация может сопровождаться разрывом одних и образованием других связей. Особенно часто наблюдаются перегруппировки с миграцией атома водорода. Характерный признак перегруппировочных ионов – постоянство их относительной интенсивности при изменении давления или понижении энергии ионизирующих агентов. Описания механизмов их образования основаны на различных допущениях, но перегруппировочные ионы часто характерны для каждой группы соединений и поэтому важны для расшифровки масс спектров.
Метастабильные ионы, как и перегруппировочные ионы, являются разновидностью осколочных. Если распад молекулярного иона происходит на пути между выходным отверстием и входом в масс-анализатор (время жизни около 10-6 сек), то в масс-спектре наблюдаются метастабильные ионы. Они обычно дают пики с дробным значением массы и с характерным внешним видом: диффузные, размытые, с низкой интенсивностью. Размытость пика связана с тем, что распад первичного иона протекает в разных точках траектории его движения с потерей различного количества кинетической энергии. Метастабильные ионы широко используются для установления путей фрагментации и структуры молекул исследуемого соединения.
При высоких энергиях ионизации возможна потеря молекулой сразу двух и более электронов с образованием ионов с зарядом +2 и выше (многозарядные ионы). Такие ионы будут иметь сооношения m/z равными m/2, m/3 и т.д. Если значение массы m нечетное, в масс-спектре будут регистрироваться ионы с дробными m/z, что позволяет отличать многозарядные ионы от однозарядных. Достаточно часто двухзарядные ионы образуются из ароматических соединений. Их интенсивности значительны у соединений со стабильной кольцевой (циклической) структурой, особенно если в ней содержатся гетероатомы: азот, кислород. На гетероатоме в молекулярном ионе локализуется положительный заряд, что облегчает удаление следующего электрона из иона без его диссоциации. Многозарядные ионы также могут претерпевать фрагментацию.
Вероятность образования отрицательных ионов в тысячи раз меньше, чем образования положительных ионов. Масс-спектр отрицательных ионов много беднее, но может давать важную информацию о строении молекул. Такие ионы образуются в результате: резонансного захвата молекулой электрона (AB + e- →AB-), диссоциативного резонансного захвата (AB+e- → A- + B), ион-молекулярных реакций (AB+C-→ ABC-) и при распаде молекулы на пару ионов (AB→A- + B+).
В масс-спектрах органических соединений относительно интенсивные пики молекулярного иона сопровождаются «сателлитами» в области бóльших массовых чисел. Это связано с тем фактом, что у «биологических» элементов (С, Н, О, N, S) в природе более распространены легкие изотопы. Пики изотопных ионов имеют массы на 1, 2, 3 и т.д. а.е.м. больше, чем первичный молекулярный ион. Изотопные пики в масс-спектрах облегчают отнесение пиков молекулярных ионов, установление брутто-формулы вещества.
Эти общие правила обычно весьма конкретны при установлении качественных корреляций между структурой изомеров какого-либо типа соединений и позволяют выбрать характеристические пики и характеристические потери, лежащие в основе идентификации неизвестного соединения. Искусство расшифровки спектра в значительной мере состоит в умении из большого числа пиков выделить такие, которые увязываются в определенные серии – последовательности фрагментации исходного иона. Когда такие серии выявлены, восстановить картину распада и, следовательно, структуру анализируемого вещества уже значительно проще, особенно если исследователь располагает общими сведениями о характерных путях фрагментации соединений данного класса.
На практике не стоит забывать также про следующие закономерности молекулярной фрагментации:
вероятность фрагментации возрастает с ослаблением прочности разрываемой связи
в первую очередь разрываются одинарные С–С связи, в то время как кратные (двойные, тройные) едва затрагиваются
связи С–С рвутся легче, чем связи С–Н
при наличии карбонильной группы происходит разрыв связей "по обе стороны" от нее
относительная интенсивность осколочных ионов возрастает при возможности их стабилизации за счет отрыва таких прочных нейтральных фрагментов как Н2О, СО, С2Н2, HCN, С2Н4, СО2.
