
- •58 Лекция 14. Масс-спектрометрия лекция 14. Масс-спектрометрия Что такое масс-спектрометрия?
- •Ионы в электрическом и магнитном полях Масса и заряд
- •Ионы в электромагнитном поле. Закон Лоренца
- •Разрешающая способность масс-спектрометрии
- •Точность измерения массы
- •Методы ионизации
- •От ионов в растворе к ионам в газовой фазе
- •Электронная ионизация
- •Ионизация полем
- •Бомбардировка быстрыми атомами
- •Плазменная десорбция
- •Ионизация лазерной десорбцией при помощи матрицы
- •Химическая ионизация при атмосферном давлении
- •Фотонная ионизация при атмосферном давлении
- •Ионизация лазерной десорбцией с поверхности кремния
- •Ионизация электрораспылением
- •Наноэлектрораспыление
- •Сравнение возможностей различных методов образования ионов
- •Масс-спектрометры Общая архитектура масс-спектрометра
- •Чувствительность
- •Динамический диапазон
- •Вакуумирование
- •Различные типы масс-анализаторов
- •Масс-спектрометры с одиночной и двойной фокусировкой
- •Квадрупольный масс-фильтр
- •Kвадрупольная ионная ловушка
- •Масс-спектрометрия с фурье-преобразованием
- •Времяпролетная масс-спектрометрия
- •Детекторы
- •Тандемная масс-спектрометрия
- •Орбитальная ловушка ионов
- •Масс-спектры биологических макромолекул Представление масс-спектра вещества и его интерпретация
- •Масс-спектры простых соединений
- •Масс-спектры биологических макромолекул
- •Нуклеиновые кислоты
- •Карбогидраты
58 Лекция 14. Масс-спектрометрия лекция 14. Масс-спектрометрия Что такое масс-спектрометрия?
Джон Фенн, изобретатель метода ионизации электрораспылением для биомолекул, лауреат Нобелевской премии по Химии 2002 годa, возможно, дал наиболее точный ответ на этот вопрос:
«Масс-спектрометрия – это искусство измерения молекулярного веса атомов и молекул. Информации о массе или весе всегда полезна, часто необходима, а иногда и достаточна для идентификации частицы. На практике, интересующие нас молекулы ионизируются, а затем траектории полученных ионов анализируются как функция различных комбинаций электрических и магнитных полей. Несомненно, ключевым моментом метода является переход молекул нейтрального вещества в ионы».
Ионы в электрическом и магнитном полях Масса и заряд
Существенное отличие масс-спектрометрии (MS) от других аналитических физико-химических методов состоит в том, что оптические, рентгеновские и некоторые другие методы детектируют излучение, поглощение или рассеяние энергии молекулами или атомами, а масс-спектрометрия имеет дело с самими частицами вещества. Масс-спектрометрия измеряет их массы, вернее соотношение массы к заряду. Для этого используются законы движения заряженных частиц в магнитном или электрическом полях. Масс-спектр – это просто сортировка заряженных частиц по их массам (точнее отношениям массы к заряду).
Ионы в электромагнитном поле. Закон Лоренца
В масс-спектрометрии для измерения соотношений массы к заряду, используются законы движения заряженных частиц в магнитном или электрическом поле, носящие имя их первооткрывателя Лоренца.
Ускоряющийся ион, покидая источник, приобретает кинетическую энергию
![]() (7.1)
(7.1)
где z
– это заряд иона, Vуск
– ускоряющая разность потенциалов, m
– масса иона, а u
– его скорость. В
однородном магнитном поле B,
перпендикулярном его траектории, ион
испытывает действие силы Лоренца
F,
которая перпендикулярна как B,
так и u
(рис. 7.1 а). Сила Лоренца F
– это сила, испытываемая анионом с
зарядом (z),
движущимся в электромагнитном поле.
![]() ,
где E
– напряженность электрического поля,
а
,
где E
– напряженность электрического поля,
а
![]() – векторное произведение напряженности
магнитного поля B
и скорости иона u.
– векторное произведение напряженности
магнитного поля B
и скорости иона u.
Результирующая траектория иона в магнитном поле представляет собой окружность с радиусом r, поскольку сила Лоренца уравновешивает центробежную силу.
![]() (7.2)
(7.2)
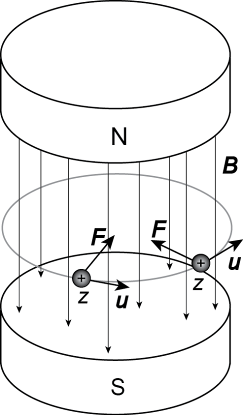
а) б)
Рис. 7.1. а) Сила Лоренца F, действующая на заряженную частицу в магнитном поле B. б) Движение заряженных частицы в электрическом и магнитном полях. В обоих случаях магнитное поле направлено перпендикулярно плоскости
Величина отношения массы к заряду m/z дается выражением
![]() (7.3)
(7.3)
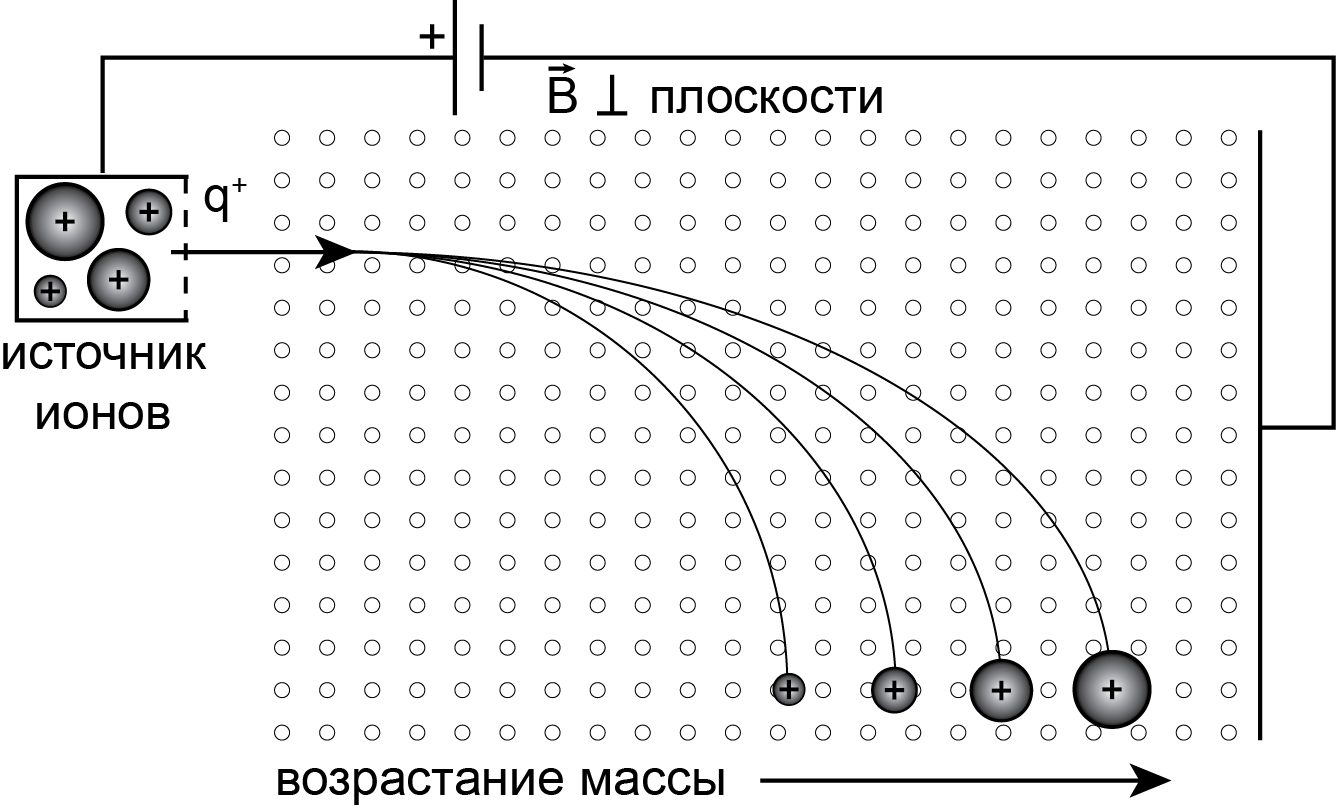
Из уравнения 7.3 следует, что в постоянном магнитном поле самые легкие ионы имеют траекторию наименьшего радиуса, который увеличивается c ростом массы иона и напряженности магнитного поля (рис. 7.1 б).
Масс-спектрометр, отклоняющий ионы по разным траекториям в соответствии с их массой может быть уподоблен стеклянной призме, разлагающей белый падающий луч света в спектр разных цветов, в соответствии с их показателем преломления. Отличие лишь в том, что разложение в спектр идет по линейному закону, тогда как в масс-спектрометре – по параболическому (рис. 7.2).
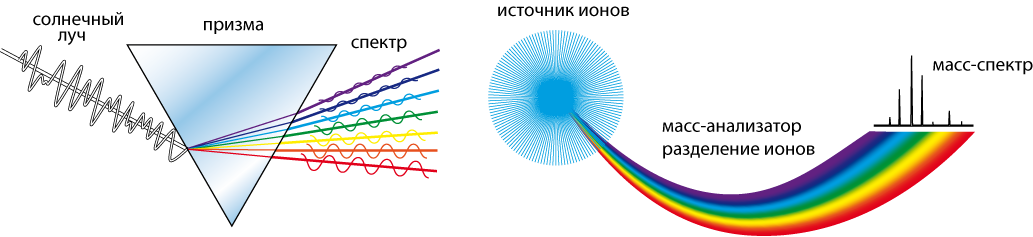
Рис. 7.2. Стеклянная призма, разлагающая белый падающий луч света в спектр разных цветов и масс-спектрометр (масс-анализатор), отклоняющий ионы по разным траекториям
Однако существование в природе изотопов химических элементов осложняет сортировку заряженных частиц по их массам и делает необходимым уточнение понятия массы.
Моноизотопная масса
В большинстве химических элементов присутствуют природные изотопы, каждый из которых обладает уникальной массой и природным уровнем обогащения. Моноизотопная масса – это масса наилегчайшего стабильного изотопа элемента. Например, существуют два основных изотопа углерода: 12C и 13C, с массами 12 000 000 (моноизотопная) и 13 003 355, и природным содержанием каждого 98.9% и 1.1%, соответственно. Аналогично есть два природных изотопа азота – 14N и 15N, с массами 14 003 074 (моноизотопная) и 15 000 109, и их соотношением 99.6% и 0.4%, соответственно. Моноизотопный пик означает, что все атомы углерода в молекуле являются атомами 12C, все атомы азота – 14N, все атомы кислорода – 16O и т.д. Моноизотопная масса молекулы, следовательно, получается сложением моноизотопных масс всех ее элементов.
Иногда моноизотопные массы называют точными массами. В таблице 7.1 представлено соотношение точных масс с номинальными массами основных биологических элементов.
Таблица 7.1. Соотношение точных масс с номинальными массами для некоторых элементов
Элемент |
Номинальная масса |
Точная масса |
C |
12 |
12.000000 |
H |
1 |
1.007825 |
O |
16 |
15.994915 |
N |
14 |
14.003074 |
P |
31 |
30.973765 |
S |
32 |
31.972974 |
F |
19 |
18.998405 |
Измеренная масса
Когда измерения проводятся на больших статистических ансамблях молекул, то они, как правило, содержат не только наилегчайшие изотопы элементов, но также один или более атомов тяжелых изотопов. Вклад пиков тяжелых изотопов в молекулярный ионный кластер зависит от суммы значений, учитывающих содержание и вес каждого элемента. Теоретическая вероятность появления кластеров этих изотопов может быть вычислена с помощью бинома Ньютона:
![]() (7.4)
(7.4)
где a – это процентное природное содержание легкого изотопа, b – процентное природное содержание тяжелого изотопа, а m – число атомов элемента в молекуле. Для небольших молекул, таких как n-бутан (C4H10), существует некоторая вероятность (~ 4%), что одна молекула природного n-бутана будет содержать атом 13C. Вероятность нахождения двух или трех таких атомов в одной молекуле пренебрежительно мала. Для биологических макромолекул, состоящих из нескольких сотен атомов углерода и азота, распределение изотопов становится крайне сложным, однако может быть рассчитано с помощью коммерческих программ.
Средняя масса
Средняя химическая масса элемента – это сумма масс всех его стабильных изотопов с учетом их содержания (например, 98.9% для 12C и 1.1% для 13C дадут среднюю массу 12.011 для атома углерода). Таким образом, средняя масса молекулы равна сумме средних химических масс ее элементов.
