
- •22 Лекция 13. Ч2. Дифференциальная сканирующая микрокалориметрия Термодинамика структурных превращений в нуклеиновых кислотах, липидах и сахарах
- •Синтетические гомо- и гетеронуклеотиды
- •Кривая плавления двойной спирали днк
- •Комплексы днк с белками
- •Изотермическая калориметрия титрования Изотермический калориметр
- •Проведение измерений и требование к образцам
- •Связывание: энтальпия и теплоемкость
- •Константы аффинности
- •Реакции с высокими константами связывания
- •Конструирование (дизайн) лекарственных препаратов
- •Изотермическая калориметрия титрования и дифференциальная сканирующая калориметрия
- •Конструирование лигандов
- •Соотношение между энергией связывания и структурой
Изотермическая калориметрия титрования и дифференциальная сканирующая калориметрия
Температурную зависимость энтальпии связывания можно интерпретировать как теплоемкость происходящего процесса только в том случае, когда изменение температуры не вызывает перестройку участвующих в реакции компонентов. Если же теплоемкость изменяется с температурой, как в реакции, изображенной на рисунке 17.4, то это означает, что возможны изменения компонентов под действием температуры. В этом случае целесообразно сочетать изотермическую калориметрию титрования и дифференциальную сканирующую калориметрию, что позволяет исследовать теплоемкость каждого компонента реакции в подходящем температурном диапазоне.
Здесь мы вернемся к примеру комплекса HMG-фрагмента с ДНК-дуплексом, температурная зависимость энтальпии связывания которого показана ранее на рисунке 17.4. Функции молярной парциальной теплоемкости компонентов реакции, определенные посредством дифференциальной сканирующей калориметрии, представлены на рисунке 17.7.
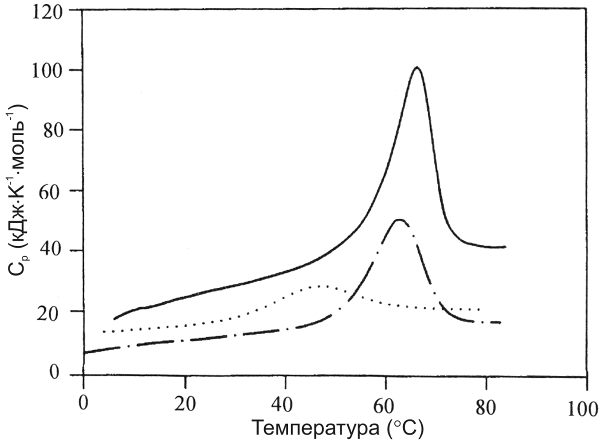
Рис. 17.7. Парциальные молярные теплоемкости компонентов взаимодействия HMG фрагмента с ДНК-дуплексом. Линия пунктир-точка обозначает дуплекс ДНК из 12 пар оснований, точечная линия –HMG- фрагмент белка Sox-5, а сплошная – их комплекс
Очевидно, что интерпретация изменения теплоемкости в процессе связывания существенно затруднена разворачиванием белка (точечная линия на рис. 17.7) и частичной диссоциацией комплекса (сплошная линия) в исследуемом температурном диапазоне. Реакции взаимодействия HMG-фрагмента белка Sox-5 с ДНК выражются как набор равновесных уравнений наподобие уравнению 17.4, а все термодинамические параметры системы оцениваются с помощью аппроксимации наблюдаемых функций теплоемкости комплекса и его свободных компонентов.
Анализ показал, что в изменениях комплекса, вызванных температурой, присутствуют две стадии (сплошная линия на рисунке 17.7). На первой стадии происходит постепенное увеличение теплоемкости, отражающее накопление тепловой энергии. На второй наблюдается диссоциация комплекса с сопутствующим разворачиванием одного из компонентов – белка.
Конструирование лигандов
Как видно из уравнения 17.3 одну и ту же константу связывания можно получить путем различной комбинаций вкладов энтропии и энтальпии. Энтальпия связывания отражает конкуренцию между взаимодействиями белок-лиганд при образовании связи между ними (например, Ван-дер-Ваальсовой и водородной) с одной стороны, и взаимодействиями белок-растворитель и лиганд-растворитель с другой. Энтропия процесса отражает в основном динамику энтропии сольватации, например, через экранирование гидрофобных групп от контакта с растворителем и изменения в конформационных энтропиях белка и лиганда.
Оптимизация вкладов энтальпии и энтропии
Оптимизация аффинности связывания включает различные тактические подходы в зависимости от того, достигается ли она за счет изменения вкладов энтальпии или энтропии. Сверхвысокая аффинность требует благоприятной энтальпии и энтропии связывания. Высокой энтропии связывания способствует дизайн конформационно ограниченных (напряженных) лигандов, имеющих высокую степень гидрофобности. Именно такими свойствами обладают ингибиторы протеазы HIV-1, которые одобрены для клинического использования.
Жесткость лигандов обеспечивает их высокую специфичность в отношении белка-цели. Однако эта специфичность делает лиганд малоэффективным в отношении родственных или мутированных целевых белков, что может приводить к лекарственной устойчивости. Иногда желательно, чтобы лиганд обладал определенной гибкостью. Тогда более низкая аффинность, обусловленная снижением энтропийного фактора связывания, должна быть скомпенсирована другими энергетически выгодными взаимодействиями. Стоит также отметить, что гидрофобность лиганда будет влиять и на его растворимость. Поэтому выбор определенного соотношения между энтропией и энтальпией определяет не только аффинность связывания, но и более общие свойства самого лиганда.
