
- •22 Лекция 13. Ч2. Дифференциальная сканирующая микрокалориметрия Термодинамика структурных превращений в нуклеиновых кислотах, липидах и сахарах
- •Синтетические гомо- и гетеронуклеотиды
- •Кривая плавления двойной спирали днк
- •Комплексы днк с белками
- •Изотермическая калориметрия титрования Изотермический калориметр
- •Проведение измерений и требование к образцам
- •Связывание: энтальпия и теплоемкость
- •Константы аффинности
- •Реакции с высокими константами связывания
- •Конструирование (дизайн) лекарственных препаратов
- •Изотермическая калориметрия титрования и дифференциальная сканирующая калориметрия
- •Конструирование лигандов
- •Соотношение между энергией связывания и структурой
Комплексы днк с белками
При изучении взаимодействия ДНК с лигандами термодинамическими методами всегда надо помнить, что изменение свободной энергии системы при комплексообразовании является ключом к пониманию направления молекулярного равновесия. Если знак ΔG отрицателен, то реакция идет спонтанно, если знак ΔG положителен, то для получения продукта реакции надо затратить энергию. Таким образом, изменение свободной энергии всегда является балансом между изменениями энтальпии и энтропии. Для реакций связывания надо затратить энергию с тем, чтобы достичь определенного состояния. При этом знак ΔG обычно отрицателен, что свидетельствует о понижении уровня энергии при образовании комплекса с новыми связями. Энтропия определяет легкость, с которой энергия распределяется между различными уровнями. Знак ΔS обычно положителен, отражая тенденцию системы к разрушению порядка путем изменения взаимодействия с растворителем и освобождения связанной воды. Все реакции комплексообразования являются «платными». Первая плата связана с потерями вращательных и трансляционных степеней свободы двумя взаимодействующими партнерами (приблизительно 60 кДж·К-1моль−1). Вторая плата идет на погашение вращения связей при комплексообразовании, например, когда лиганд встраивается в специфический карман рецептора (приблизительно 2.4 кДж·К-1·моль−1).
Лиганды – возмущающие и не возмущающие структуру ДНК
Известно, что лиганды могут взаимодействовать с двойной спиралью ДНК двумя разными способами. В первом, лиганды располагаются вдоль малой бороздки двойной спирали, практически не меняя ее структуры (рис. 16.11 а). Во втором способе лиганды встраиваются в основания ДНК, изменяя (повреждая) её структуру (рис. 16.11 б). В настоящее время создан банк структур, содержащий информацию о лигандах, которые работают по одному из перечисленных принципов и об энтальпиях переходов, которые известны из эксперимента.
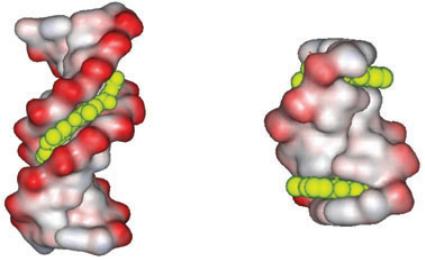
Рис. 16.11. Две модели взаимодействия ДНК с лигандами. Слева изображена модель, в которой лиганд располагается в малой бороздке ДНК. Справа – модель встраивания (интеркалирование) лиганда в структуру ДНК
Термодинамические характеристики двух типов связывания представлены на рисунке 16.12. Из этого рисунка видно, что все лиганды (а их известно на сегодняшний день около 20) на основании термодинамических данных могут быть разбиты на две группы.
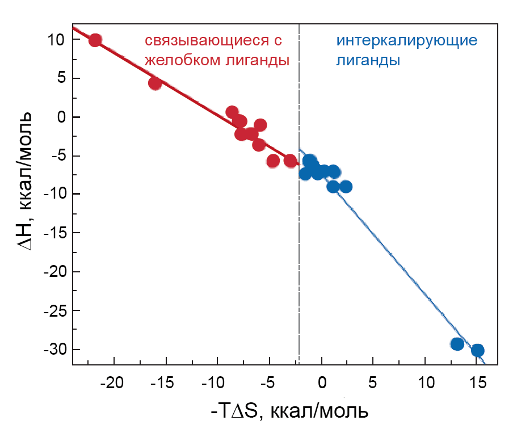
Рис. 16.12. Энтальпийная и энтропийная составляющие взаимодействия ДНК с лигандами. Связывающиеся с желобком лиганды представлены в левой части графика (красным), а интеркалирующие лиганды – в правой части графика (синим)
К первой группе относятся лиганды, располагающиеся вдоль малой бороздки ДНК. В их взаимодействие основной вклад вносит энтропийная составляющая, тогда как во взаимодействии второй группы лигандов основной вклад вносит энтальпийная составляющая. Лиганды первой группы располагаются в левой части графика зависимости энтальпии от энтропии ТΔS, тогда как лиганды второй группы занимают правую часть графика. Левая часть графика характеризуется в основном отрицательной энтальпией и отрицательной энтропией, тогда как его правая часть – отрицательной энтальпией и, в основном, положительной энтропией.
РНК
5S рРНК
5S рРНК является важным компонентом рибосомы в прокариотических и эукариотических организмах. Все проведенные исследования показали, что такая РНК может принимать множество различных конформаций в растворе, в зависимости от концентрации, ионов буфера, температуры и концентрации мочевины. 5S рРНК из E.coli существует в двух формах: А (природная форма) и B (денатурированная температурой или мочевиной форма). Переход из одной формы в другую является обратимым. По этой причине дифференциальная сканирующая калориметрия для исследования динамики структуры 5S рРНК является незаменимым инструментом, поскольку напрямую дает данные о стабильности молекулы в растворе.
На рисунке 16.13 показаны кривые плавления 5S рРНК из эукариотических организмов.
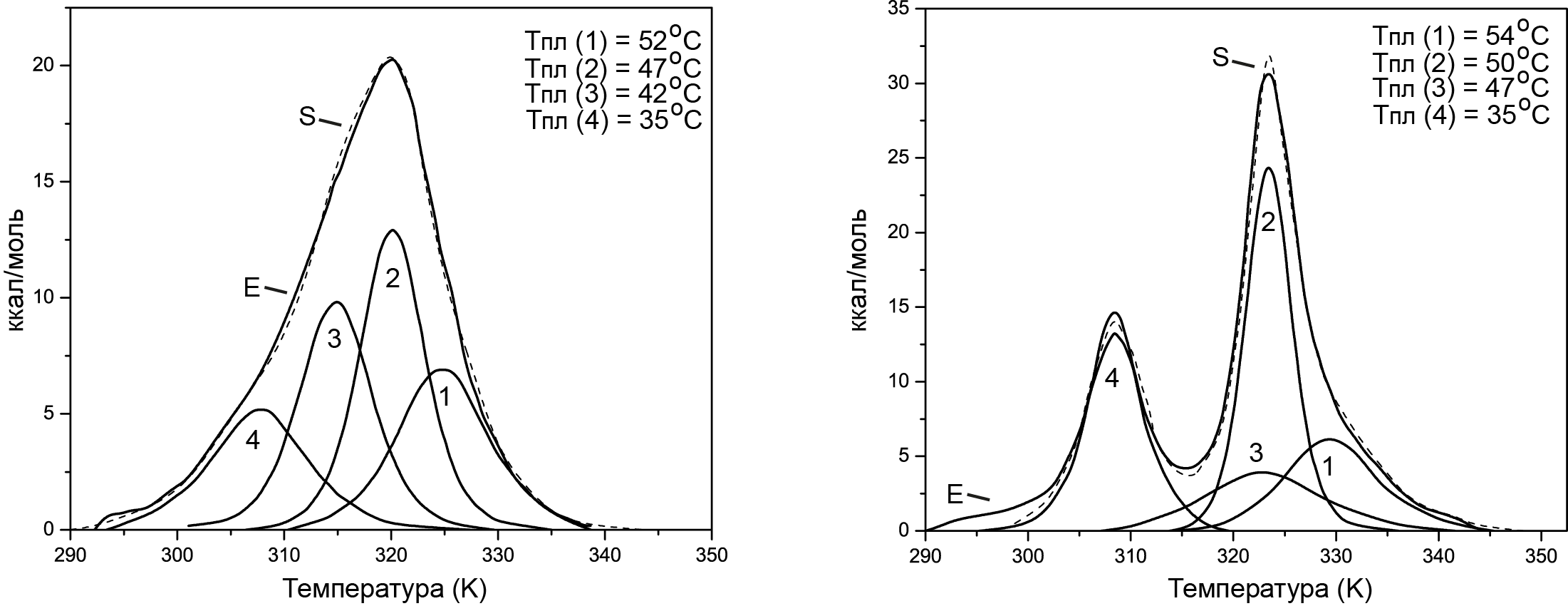
Рис. 16.13. Графики плавления 5S рРНК из зародыша пшеницы (слева) и из семян люпина (справа). Кривая, обозначенная буквой Е (сплошная) представляет собой экспериментальную зависимость теплоемкости от температуры. Кривые 1-4 отражают отдельные компоненты. Кривая S (пунктирная)– суммарная кривая
Экспериментальные значения энтальпии, рассчитанные для буфера с низкой концентрацией ионов натрия, равны 1344 кДж·К-1·моль-1 для 5S рРНК из зародышей пшеницы и 1592 кДж·К-1·моль-1 для семян люпина. Данные значения хорошо коррелируют со значениями, рассчитанных из смоделированных вторичных структур рРНК из данных организмов.
Вирусная РНК
С помощью дифференциальной сканирующей калориметрии можно также исследовать изменение стабильности различных вирусов. Так, например, подобный эксперимент был проведен для вируса желтой мозаики турнепса (Turnip yellow mosaic virus TYMV). Была исследована стабильность вируса в различных ионных условиях (рис. 16.14 а), а также различия между природным вирусом и капсидой при высвобождении РНК из вириона (рис. 16.14 б).
а) б)
Рис. 16.14. а) Кривые плавления природного TYMV-NTC вируса для разных значений pH: (---) для 5.0, (– –) для 6.65, (…) для 7.5. б) Kривые плавления капсиды вируса желтой мозаики репы, полученные после высвобождения РНК различными способами при pH 7.6. (---) давление, (– –) замораживание-оттаивание, (…) титрование щелочью
Липиды
Дифференциальная сканирующая микрокалориметрия является также важным инструментом для изучения образования мембран в смеси воды с липидами, а также фазовых переходов в них. При этом получаются сложные фазовые диаграммы как функции температуры и соотношения вода/липид. Энергетика таких систем исследуется с помощью измерения температурной зависимости теплоемкости для каждой фазы и связанных с переходами пиков.
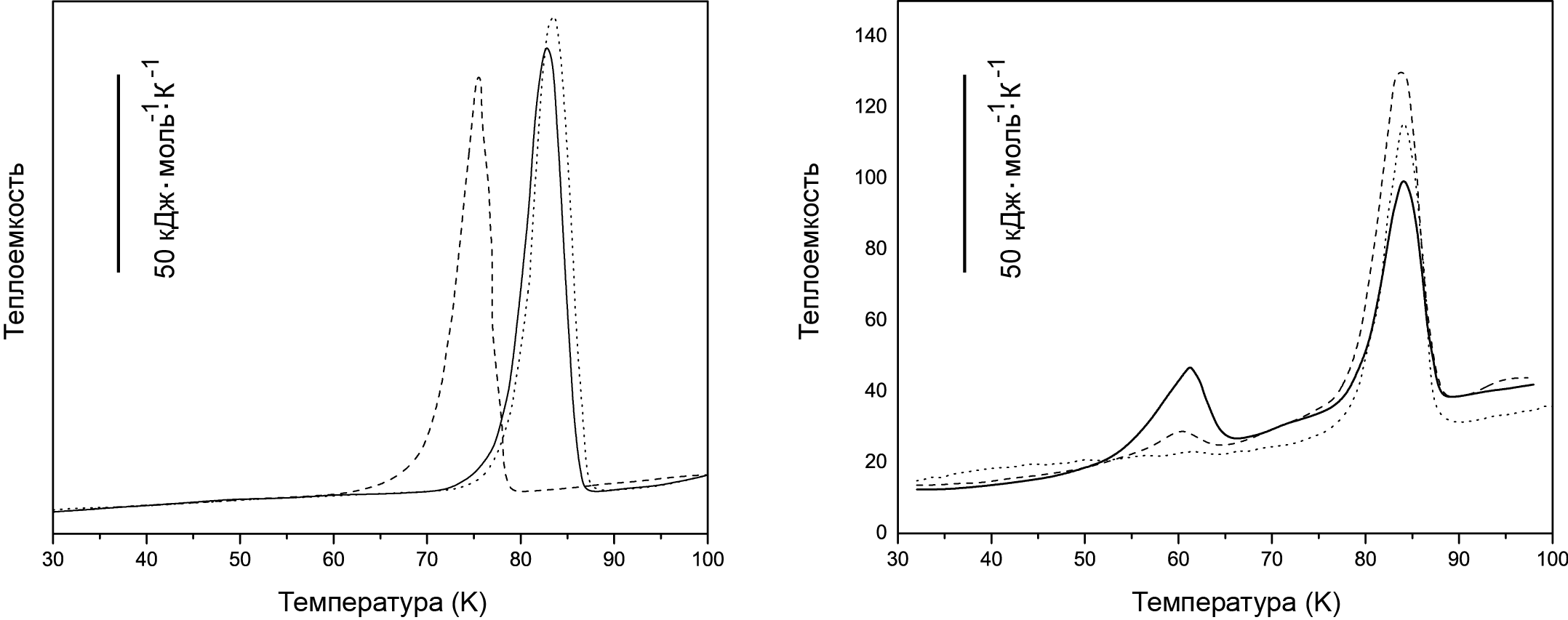
Первым, хорошо изученным примером, является система DSPC/вода (phospholipid distearoylphosphatidylcholine/water). Типичные DSC кривые показаны на рисунке 16.15.
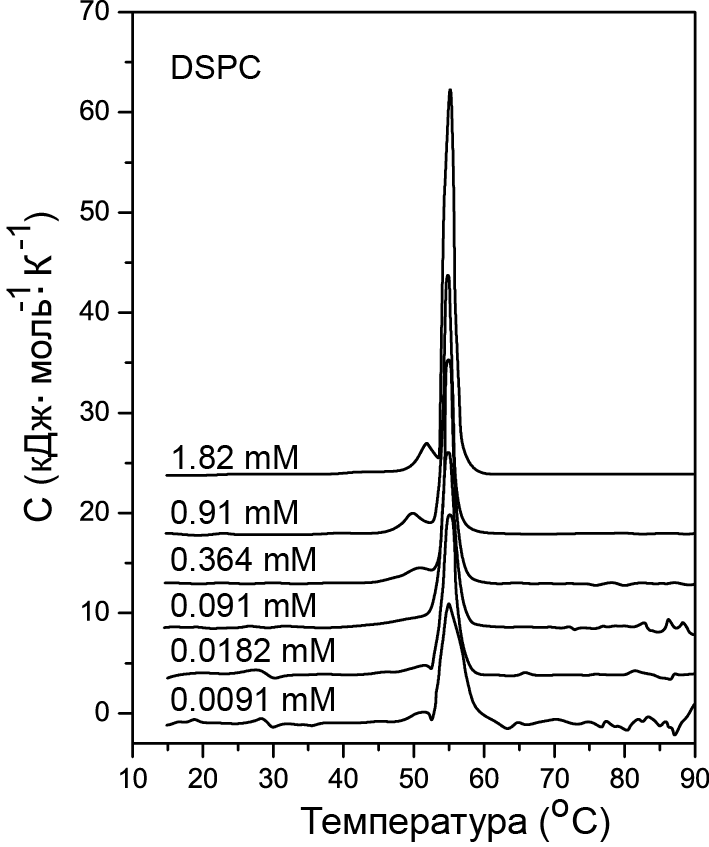
Рис. 16.15. Зависимость теплоемкости от температуры DSPC, полученная с помощью микрокалориметра VP-DSC. Объем ячейки 0.5 мл. Исходная молярность 1.82 мМ. Температура перехода 53.8 °С
Как уже отмечалось ранее, биологические мембраны могут содержать сложные системы из липидов разных классов. По этой причине, калориметрическое описание простых смесей липидов и их фазовых переходов является необходимым этапом исследования сложных природных комплексов.
Липид-белковые комплексы
Биологические мембраны содержат липид-белковые комплексы необходимые для правильного функционирования. Эти белки могут либо внедрятся в липидные бислои и быть активными с обеих сторон бислоя, либо присоединяться к одной поверхности бислоя. В обоих случаях образования подобных комплексов довольно сильно отражаются на профилях переходов, полученных с помощью DSC.
Пример DSC-кривых комплекса липида DMPC с различными другими липидами (в соотношении 6:1) до и после образования комплекса с белком GM2 (ganglioside activator), обладающим энзиматической активностью в липосомах, приведен на рисунке 16.16.
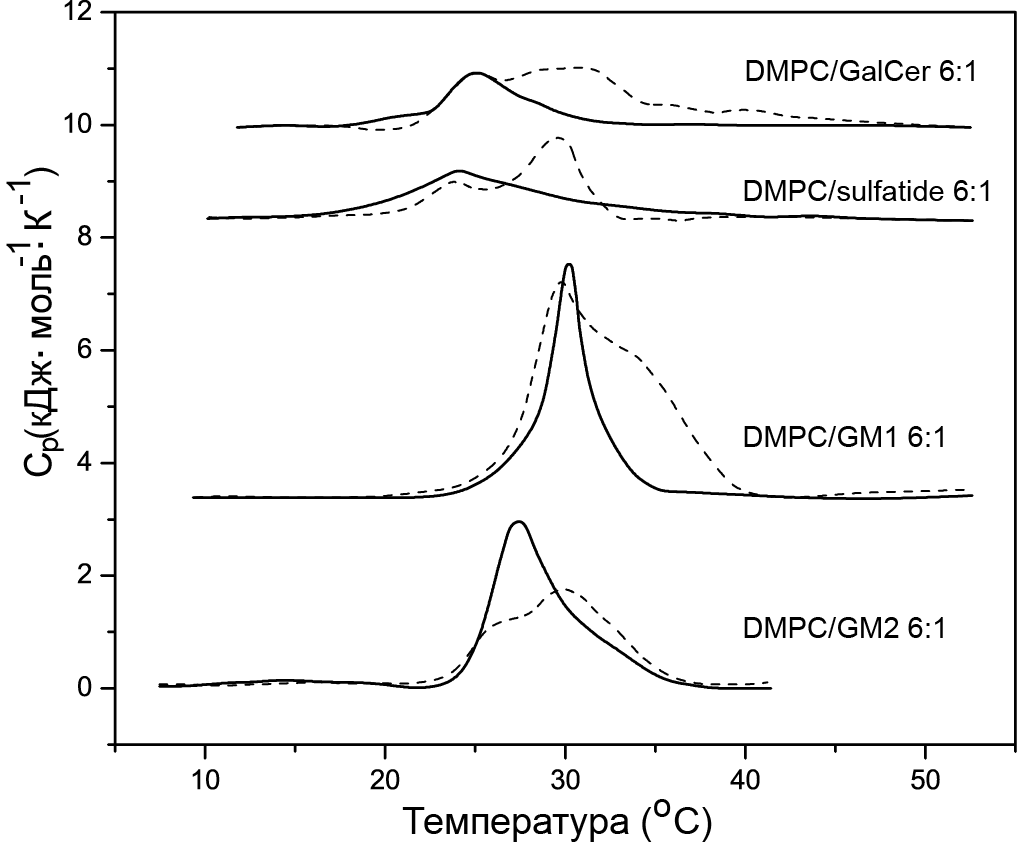
Рис 16.16. Кривые плавления для комплекса липида DMPC с различными другими липидами (в соотношении 6:1) до (непрерывная линия) и после (пунктирная линия) образования комплекса с белком GM2
Сахара
Гликопротеины
Известно, что диагностика таких заболеваний как диабет напрямую связано с контролем уровня глюкозы в крови. D-глюкоза-связывающий белок (D-glucose-binding protein (GGBP) из E. coli является инициаторным компонентом при хемотаксисе (движение микроорганизмов и отдельных живых клеток под воздействием градиента химических веществ) и имеет высокую константу связывания с глюкозой. Такой комплекс всегда присутствует в биологических жидкостях живого организма.
Эффект влияния на термостабильность этого белка в комплексе с глюкозой исследованный методом DSC приведен на рисунке 16.17.
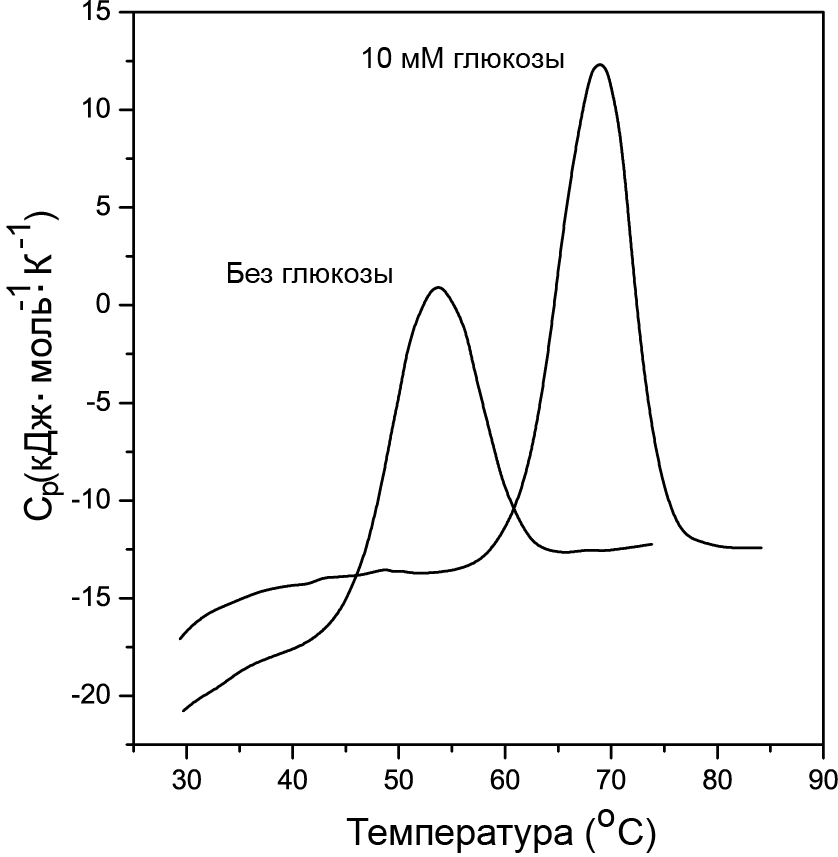
Рис. 16.17. Кривые плавления белка GGBP в 10 мМ Hepes pH 7.0 (t = 25 °C) без глюкозы и в присутствии 10 мМ глюкозы
Из приведенного графика видно, что точка плавления при pH 7.0 в присутствии 10 мM глюкозы возрастает от 55 до 70 °C. Константа ассоциации с D-глюкозой, оцененная из DSC данных при 63°C, равна 5.6 ×106 М-1.
