
- •Интерком-бинационная конверсия
- •Основные принципы флуоресценции
- •Время жизни люминесценции
- •Параметры флуоресценции и их применение к исследованию биологических макромолекул
- •4. Поляризация флуоресценции.
- •Определения поляризации и анизотропии
- •Теория поляризации для разбавленных растворов, находящихся в стеклообразном состоянии
- •Влияние вращательной диффузии на анизотропию флуоресценции. Уравнение Перрена
- •Применения измерений анизотропии в биохимии
- •Оценка микровязкости клеточных мембран
- •Вращательная диффузия белков
- •Реакции ассоциации
- •Денатурация dna
лекция 9. флуоресцентная спектроскопия
Люминисценцией является излучение фотонов электронно-возбужденными состояниями молекул. Она состоит из 2-х видов: флуоресценции и фосфоресценции. Отдельно находится так называемая биолюминесценция или хемолюминесценция, которая происходит не за счет поглощения света, а обеспечивается химической реакцией. Явление биолюминесценции широко распространено в различных биологических организмах; например, в медузах и светлячках. Основным компонентом, осуществляющим свечение этих организмов, является белок – люцефераза со связанным с ним ко-фактором – целентеразином. В биомакромолекулах люминесценция обеспечивается либо собственными хромофорами либо присоединенными к ним ковалентно или сорбированными флуоресцентными метками. В белках существуют три вида аминокислотных остатков, которые способны излучать свет после его поглощения. К ним относятся триптофан, тирозин и фенилаланин. Параметры люминесценции позволяют установить локализацию этих ароматических остатков в белках и охарактеризовать свойства их окружения.
В настоящее время метод собственной люминесценции широко используется в биофизике и биохимии благодаря относительной простоте измерения и использованию низких концентраций люминесцирующих объектов. Люминесценция происходит в результате электронного перехода возбужденной поглощением фотона света молекулы хромофора в основное невозбужденное состояние. Это явление можно пояснить следующей условной схемой уровней энергии, называемой схемой Яблонского.
T2
Фосфоресценция
S1
S0
Поглощение
Интерком-бинационная конверсия
S2
Интенсивность поглощения света единицей объема вещества связана с экспериментально измеренными величинами известной формулой Ламберта-Бэра
Iпогл. = I0 exp(- l c),
где I0 – начальная интенсивность падающего света, – молекулярный коэффициент поглощения при данной частоте , l – длина пути света в поглощающем веществе, с – концентрация молекул поглощающего вещества.
Поглощение кванта света, в зависимости от его энергии, переводит молекулу из основного состояния S0 на один из колебательных уровней возбужденных состояний S1, S2 и т.д. В концентрированной среде энергия возбуждения состояния S2 или любого другого высокого состояния (выше S1), быстро диссипирует благодаря неупругим столкновениям и молекула безызлучательно достигает нулевого колебательного уровня состояния S1. Безызлучательные переходы между электронными состояниями одной и той же мультиплетности называются внутренней конверсией. При этом энергия возбуждения переносится во внешнюю среду. Безызлучательная дезактивация S1 S0 происходит по такому же механизму. Излучательные переходы в молекуле между синглетными уровнями приводят к появлению флуоресценции. Сравнение процессов флуоресценции S0 S1 и поглощения S0 S1 показывает, что наиболее длинноволновая линия поглощения совпадает по энергии с наиболее коротковолновой линией излучения. Эта линия называется О – О линией.
Основные принципы флуоресценции
Благодаря внутренней конверсии поглощения спектра флуоресценции не зависит от длины волны возбуждения.
Спектр флуоресценции сдвинут в длинноволновую сторону по отношению к спектру поглощения.
Число квантов, излучаемых в единицу времени, пропорционально числу квантов, поглощаемых в единицу времени, и квантовому выходу флуоресценции:
Nf = I0(1 – 10-D)qf
где I0 – интенсивность падающего света; D – оптическая плотность раствора; qf – квантовый выход флуоресценции, который определяется как отношение числа квантов, излучаемых из возбужденного состояния, к числу квантов, поглощаемых при переходах из основного в это возбужденное состояние в единицу времени.
Спектр возбуждения флуоресценции идентичен спектру поглощения.
Время жизни люминесценции
Время жизни возбужденного состояния определяется как время, требуемое для уменьшения начального числа возбужденных состояний в «е» раз. Собственное время жизни, 0, возбужденного состояния – это среднее время жизни этого состояния в отсутствие безызлучательных процессов дезактивации.
![]()
![]()
где
qf
– квантовый выход,
![]() – собственное время жизни, а f
– измеряемое время жизни. При непрерывном
облучении раствора в течении периода
времени, более длительного, чем время
жизни флуоресценции, система достигает
стационарного состояния, когда скорость
образования синглетных возбужденных
молекул S1,
будет равна скорости их исчезновения
в ходе различных процессов дезактивации.
– собственное время жизни, а f
– измеряемое время жизни. При непрерывном
облучении раствора в течении периода
времени, более длительного, чем время
жизни флуоресценции, система достигает
стационарного состояния, когда скорость
образования синглетных возбужденных
молекул S1,
будет равна скорости их исчезновения
в ходе различных процессов дезактивации.
Параметры флуоресценции и их применение к исследованию биологических макромолекул
Спектры флуоресценции.
–
мера положения
спектра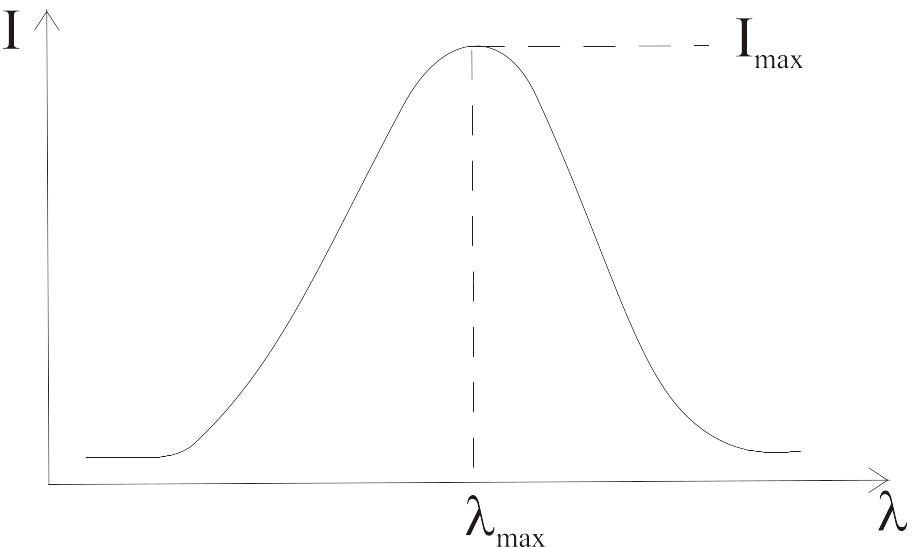
![]()
1.
Интенсивность спектра флуоресценции
(квантовый выход) белков зависит от
близости собственных тушащих групп
(COO,
![]() ,
S–S
связь) и доступности внешним тушителям
(I,
Au,
Cu,
акриламид, Cs).
,
S–S
связь) и доступности внешним тушителям
(I,
Au,
Cu,
акриламид, Cs).
Уравнение Штерна–Фольмера.
![]()
q0 – квантовый выход (интенсивность) флуоресценции в отсутствие тушителя;
q – квантовый выход (интенсивность) флуоресценции в присутствие тушителя с концентрацией [Q];
K
![]()
развернутый белок
нативный белок
Зависимость
Штерна- Фольмера
[Q]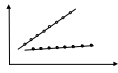
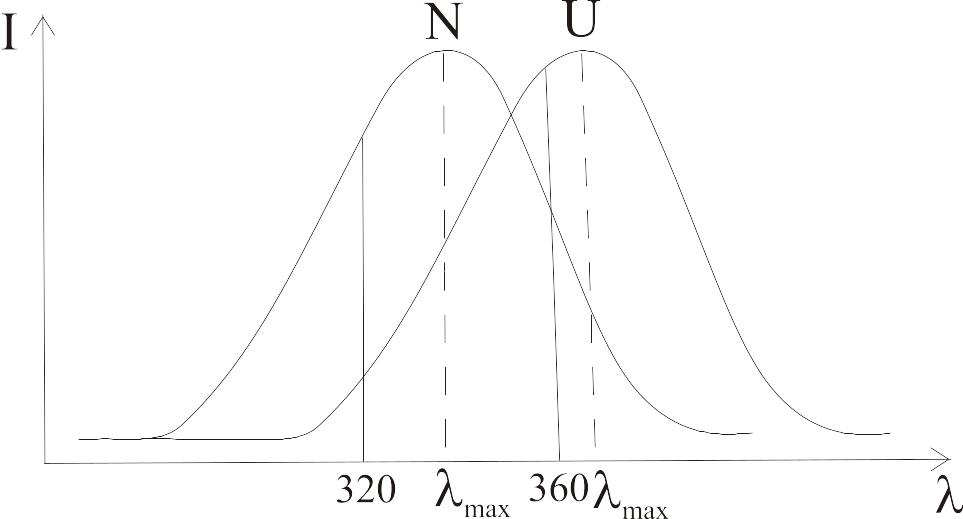
2. Положение спектра флуоресценции (max, А) для большинства флуорофоров зависит от полярности их окружения. Чем меньше полярность, тем более коротковолновое положение спектра флуоресценции. Положение спектра флуоресценции тирозина практически не зависит от полярности.
3. Миграция энергии возбуждения происходит в случае перекрывания спектра поглощения акцептора со спектром поглощения донора.
Различают два вида: 1) перепоглощение – излучение кванта света молекулой донора и его поглощение молекулой акцептора; 2) безызлучательный перенос энергии возбуждения от донора к акцептору благодаря прямому электродинамическому взаимодействия между возбужденной и не возбужденной молекулами. Определяется не только перекрыванием спектров поглощения акцептора со спектром поглощения донора, но и критическим расстоянием R0 между донором и акцептором, на котором вероятность переноса равна вероятности спонтанной дезактивации.
Эффективность переноса энергии определяется как
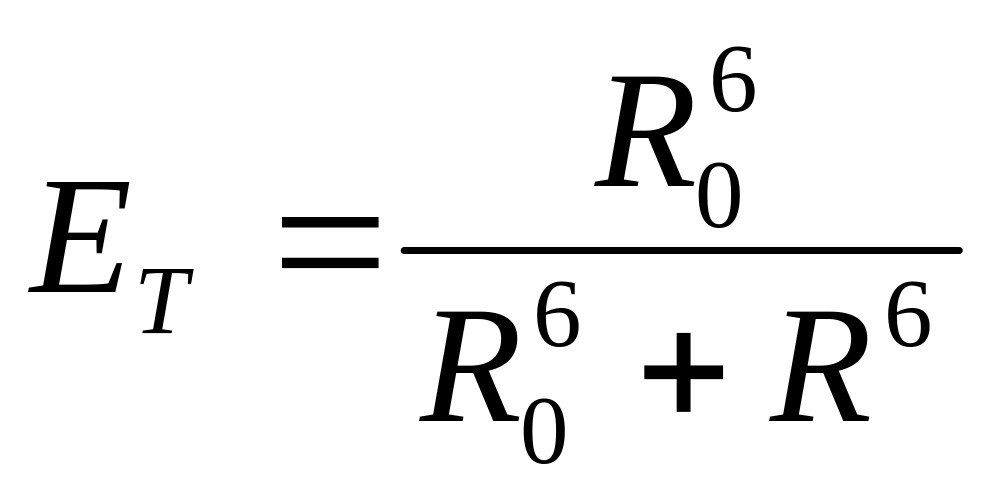 или
или
![]() ,
где
,
где
![]() .
.
Перенос энергии возбуждения флуоресценции был использован для определения расстояний между хромофорами в различных биологических макромолекулах и их комплексах и показал себя как очень эффективная спектроскопическая линейка для измерения расстояний в интервале значений 20 – 100 Å.
Чтобы наблюдать явление переноса энергии и оценивать расстояния между биологическими молекулами в клетках широкое распространение получило семейство зеленых флуоресцентных белков. Во-первых, они могут экспрессироваться в различных клетках, где становятся спонтанно флуоресцирующими без ко-факторов. Во-вторых, эти белки могут быть пришиты к белку-хозяину сохраняя при этом способность к флуоресценции и функцию белка-хозяина. Мутагенез этого семейства дало в настоящее время достаточно большое количество мутантов с разными спектральными свойствами, которые могут быть использованы как доноры или акцепторы в методе резонансного переноса энергии.
