
- •15 Лекция 5 лекция 5. Равновесная и скоростная седиментация Два типа экспериментов
- •Молекулярная масса
- •Константы связывания
- •Парциальный удельный объем
- •Седиментация в градиенте плотности
- •Метод скоростного зонального центрифугирования
- •Вычисление молекулярных масс белков из данных скоростного зонального центрифугирования и гель-фильтрации
- •Метод равновесной седиментации в градиенте плотности
Вычисление молекулярных масс белков из данных скоростного зонального центрифугирования и гель-фильтрации
В этом параграфе мы расскажем о простом подходе к вычислению молекулярных масс белков из данных скоростного зонального центрифугирования и гель-фильтрации, который был предложен в 1966 г. Л. Сейгелом и К Монти (L. Siegel, K. Monte). В нем для вычисления молекулярной массы белка нет необходимости в аналитической ультрацентрифуге, а достаточно иметь только препаративную ультрацентрифугу и гель-фильтрационную колонку - приборы, которые имеются в любой биохимической лаборатории.
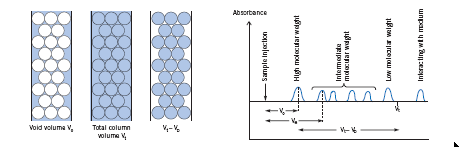
Сначала несколько слов о гель-фильтрационной колонке. Она представляет собой молекулярное ситоГель-фильтрация, иногда называемая эксклюзионной хроматографией - разновидность хроматографии, в ходе которой молекулы веществ разделяются по «размеру» за счёт их разной способности проникать в поры стационарной фазы. При этом первыми выходят из колонки наиболее крупные молекулы (бо́льшей молекулярной массы), способные проникать в минимальное число пор стационарной фазы. Последними выходят вещества с малыми размерами молекул, свободно проникающие в поры. В отличие от адсорбционной хроматографии, при гель-фильтрации стационарная фаза остается химически инертной и с разделяемыми веществами не взаимодействует. На колонку наносят раствор образца, объем которого является лимитирующим для качества хроматографии. Для аналитических разделений он не должен превышать 0,1 % от CV (общего объема колонки), а для препаративной очистки он должен быть не выше 8-10 % от CV. Колонка наполняется порошком, частицы или гранулы которого имеют поры определенного диаметра. Высокомолекулярные вещества, не входящие в поры, проходят между гранулами, поэтому их объем удержания равен объему колонки за вычетом объема стационарной фазы (так называемый, свободный объем). Они элюируются первыми. Молекулы средних размеров помещаются в поры сорбента, но не полностью. Поэтому их объем удержания несколько выше свободного объема. Они элюируется вторыми. Самые мелкие молекулы свободно входят в поры вместе с молекулами растворителя. Поэтому их объем удержания в колонке намного выше свободного и приближается к общему объему колонки (то есть 100 % CV). Они элюируются последними (рис. 25ДД)
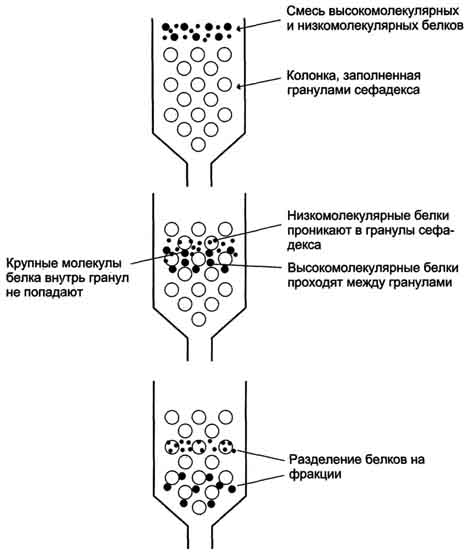
Методология вычислений молекулярной массы проста. В калиброванной гель фильтрационной колонке определяется стоксовский радиус R0, который, как мы знаем, связан с коэффициентом трения уравнением Стокса. Затем белок центрифугируется в сахарозном или глицерольном градиенте для определения s. Далее, получаем простую связь, между молекулярной массой, константой седиментации и стоксовским радиусом R0:
M = 4.2 s·R0,
где s в единицах Сведберга, а R0 в нанометрах, а М в Дальтонах. Главный недостаток такого похода – относительно невысокая точность (±10%), а главное достоинство – простота оборудования и применение к гетерогенным образцам.
Метод равновесной седиментации в градиенте плотности
Большие силы, которые генерируются при центрифугировании, могут быть использованы для создания естественного градиента плотности, образованного небольшими растворенными малекулами. Такой градиент может быть достаточно просто реализован на практике при использовании солей растворов тяжелых металлов, таких как цезий хлор (CsCl) или рубидий хлор (RbCl). В поле такого градиента исследуемые макромолекулы будут распределяться в соответствии с их пл. Принципиальная схема такого эксперимента представлена на рисунке 25.7 для трех типов частиц, отличающихся по плотности.
Смешение
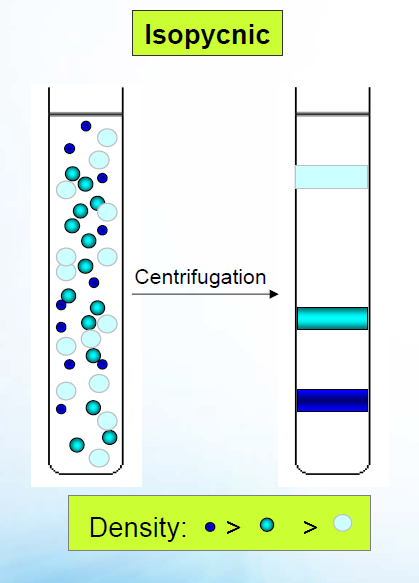
Рис. 25. Принцип седиментации в градиенте плотности. Различные плотности трех типов частиц изображены глубиной красного цвета
Выведем уравнение, описывающее поведение частицы в градиенте плотности после достижения равновесия. Рассмотрим молекулярный раствор, состоящий из трех компонентов: молекулы растворителя (компонент 1), исследуемые макромолекулы (компонент 2), и низкомолекулярные растворенные вещества (CsCl и RbCl) (компонент 3).
Низкомолекулярные растворенные вещества будут распределяться в ячейке таким же образом, что и большие молекулы.
Если плотность, ρ, компонента 2 располагается между двумя значениями крайних плотностей растворителя, то макромолекула будет устремляться в ту область ячейки, где ее плавучая плотность равна нулю, т.е. ρ = ρ0. Ширина полосы компонента 2 является функцией макромолекулярной массы и крутизны градиента локальной плотности. Для молекул с большими молекулярными массами полосы будут очень узкими из-за их маленького коэффициента диффузии. Напротив, для веществ с маленькими молекулярными массами уширение полос настолько велико, что метод практически неприменим для глобулярных белков. Нативная ДНК, например, дает такие узкие полосы, что меченная по 15N (‘тяжелый азот’) молекула четко отделяется от природной молекулы, 14N (‘легкий’ азот”) при равновесном центрифугировании в градиенте плотности CsCl. При равновесной седиментации в CsCl, различие в плотности молекул ДНК, содержащих 15N и 14N изотопы равно 0.014 г·см-3. Результатом этого является тот факт, что расстояния в стандартной ультрацентрифужной ячейке между полосами таких образцов равны 0.5 мм при скорости 40 000 об·мин-1. Именно эти изотопы были использованы в опытах Месселсона и Сталя (Messelson и Stahl) по исследованию механизма репликации ДНК.
Наиболее удивительным свойством модели двойной спирали ДНК Уотсона и Крика является комплементарность двух цепей ДНК, по принципу которой и происходит удвоение цепи. В результате появляются две дочерние дуплексные молекулы ДНК, одна которых является родительской цепью ДНК. Этот процесс получил название полуконсервативного механизма репликации и показан на рисунке 25.8.
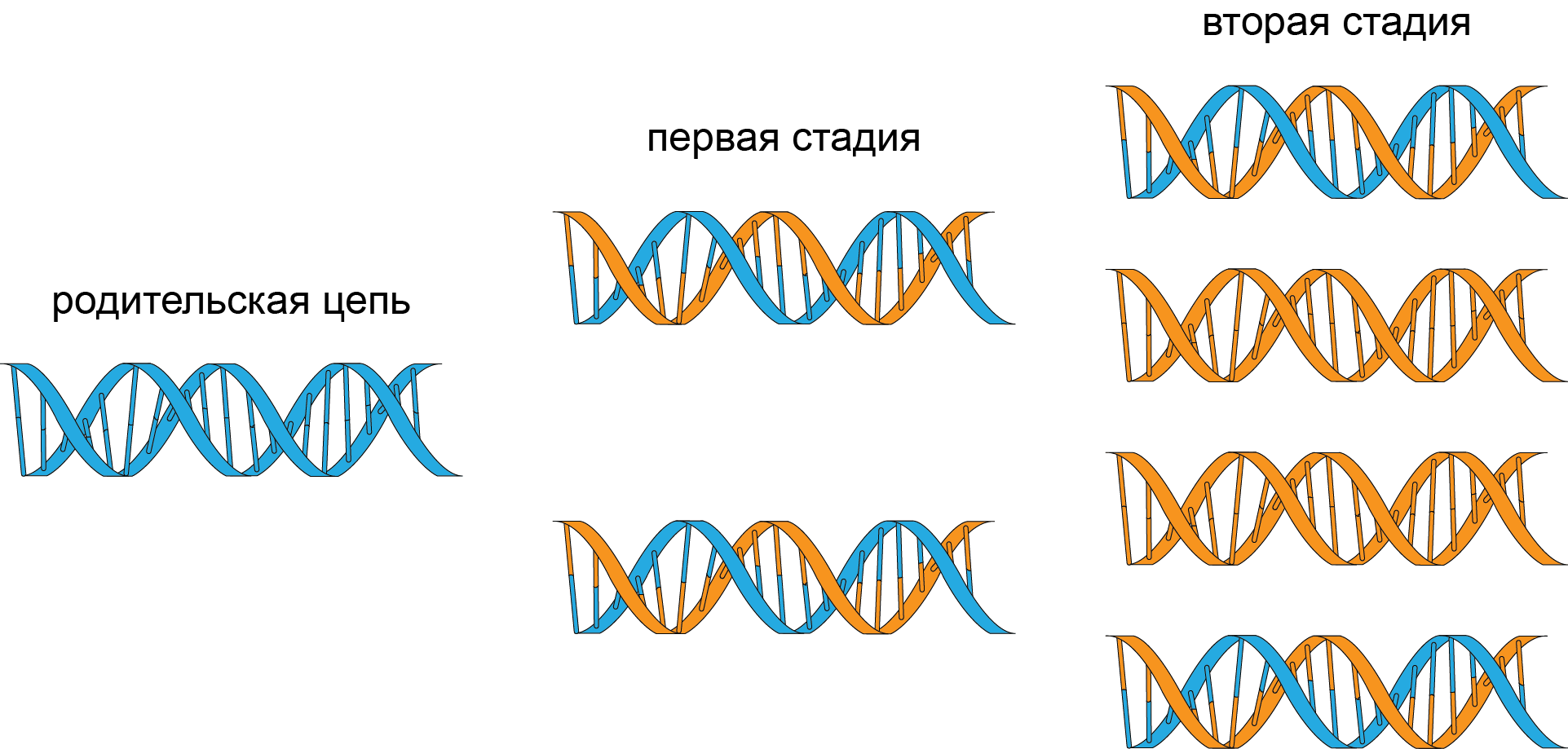
Рис. 25.8. Полуконсервативный механизм репликации ДНК. Каждый вновь образованный дуплекс на первой стадии деления содержит одну родительскую цепь. На второй стадии генерация состоит из двух гибридных ДНК и двух полностью новых ДНК. Вновь реплицированная цепь обозначена оранжевым цветом, родительская – синим
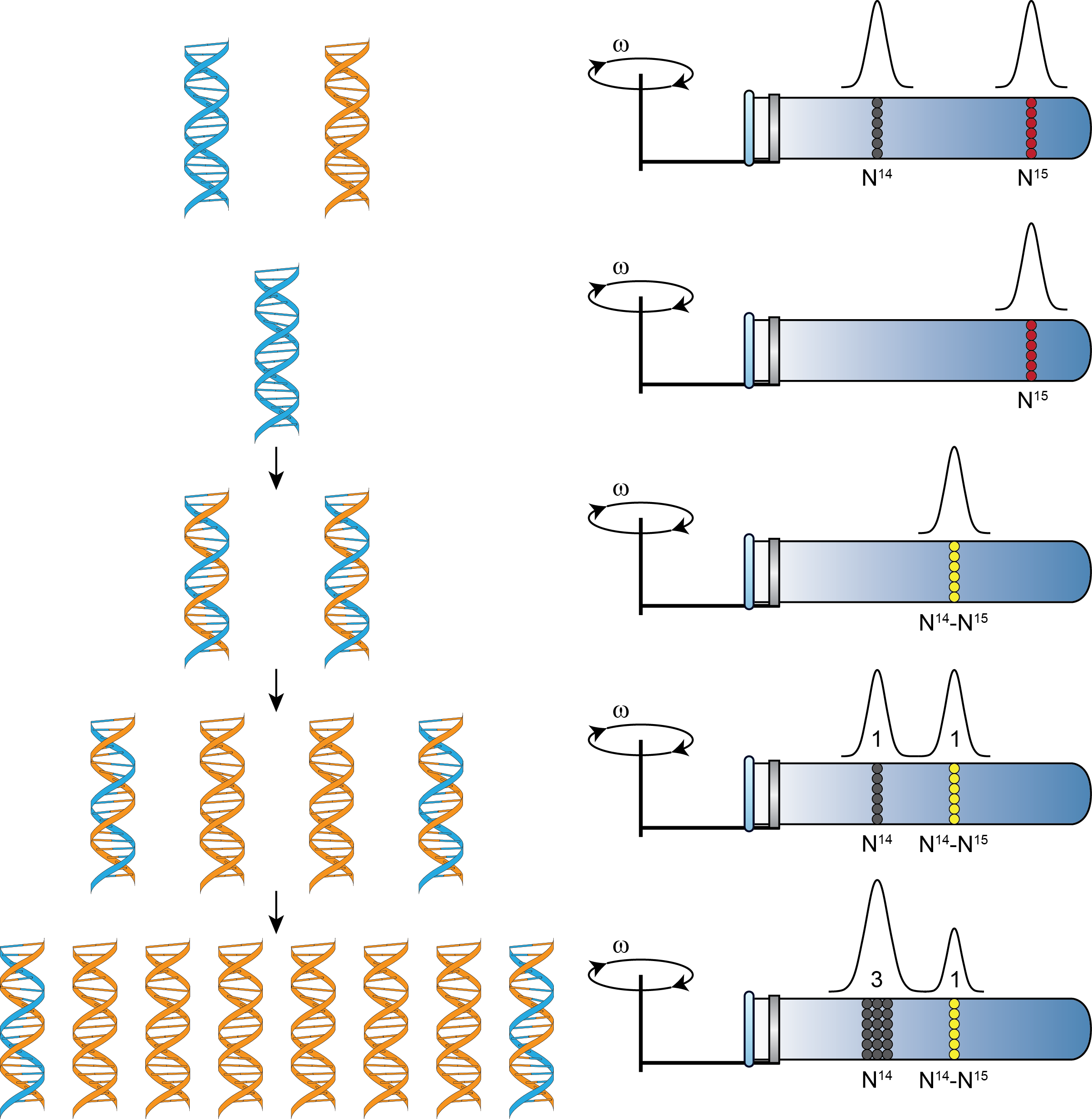
Для экспериментального доказательства этого механизма, Меселсон и Сталь поставили опыты, суть которых кратко состоит в следующем. Они вырастили клетки E.coli на среде, содержащей в качестве источника тяжелого азота, 15N хлорид аммония. Затем меченые 15N азотом клетки E. coli были перенесены на среду с обычным азотом 14N для продолжения их роста. Образцы отбирали через определенные интервалы времени. Затем из клеток экстрагировали ДНК, плавучую плотность которой определяли методом центрифугирования в градиенте плотности CsCl (рис. 25.9).
 доп.
надписи цвета
доп.
надписи цвета
Рис. 25.9. Схематическое представление результатов экспериментов Меселсона и Сталя. (а) Контроль: смесь тяжелой(15N) и легкой (14N) ДНК. (б) Исходное деление начинается с родительская тяжелой ДНК (в) ДНК после первого деления на 14N среде; (г) ДНК после двух делений на 14N (д) ДНК после трех делений на 14N среде.
После первого деления выделенная ДНК шла одной полосой в градиенте плотности, положение которой было между зонами ДНК с тяжелым и обычным азотом (рис. 25.9 в). После двух делений на 14N среде выделенная ДНК давала две полосы, одну с плотностью, равной легкой ДНК, другую с промежуточной плотностью, равной гибридной ДНК, наблюдаемой после одного деления (рис. 25.9 г). После трех делений в 14N среде ДНК давала еще две полосы, подобные тем, которые наблюдались после двух делений (рис. 25.9 д). Именно такой результат, ‒ наличие полосы с промежуточной плотностью после первого и последующих делений, – и ожидался при полуконсервативном механизме деления ДНК.
