
- •44 Лекция 2 лекция 2. Биологические макромолекулы
- •I. Белки как основа жизнедеятельности организма
- •Первичная структура
- •Вторичная структура в белках
- •Полипролиновые спирали
- •Третичная структура
- •Изображение белковых структур
- •Классы белков
- •II. Нуклеиновые кислоты
- •Типы нуклеиновых кислот
- •Днк как линейная цепь из фосфатов, сахаров и оснований
- •Днк как двойная спираль
- •Более высокие уровни структурной организации днк: от нуклеосомы до хромосомы
- •Рибонуклеиновые кислоты (рнк)
- •Рнк как двойная спираль
- •Типы рнк
- •III. Углеводы Классификация углеводов
- •Циклодекстрины
- •Структуры высших порядков
- •Гликоконъюгаты
- •IV. Липиды Классификация липидов
- •Функции липидов
- •Простые липиды
- •Взаимодействие пептидов и белков с липидами
- •Биомембраны
Полипролиновые спирали
Остановимся еще на одном типе вторичной структуры – полипролиновой спирали. Пролин не может образовывать α- и β-структур из-за ограничений, налагаемым на его скелет пятичленным кольцом. Однако он может образовывать две односпиральные структуры, которые являются уникальными, поскольку не содержат водородных связей. Цепь из одних пролинов или даже участки с большим количеством пролинов в белках встречаются редко, за исключением семейства коллагена – главного белкового компонента соединительной ткани. Структурной единицей коллагена служит тропоколлаген, который представляет собой отрезок тройной спирали диаметром 1.5 нм и длиной около 280 нм. При этом индивидуальные левоспиральные цепи оказывается закрученными в правую трехзаходную суперспираль. На рисунке 2.15 показан ход трех полипептидных цепей коллагена. Особенность коллагена состоит в том, что он на одну треть состоит из самой маленькой кислоты глицина, поскольку крупные по размеру боковые группы не могут уместиться внутри тройной спирали. Такая тройная спираль является одной из самых прочных и жестких спиралей. Ее жесткость гораздо больше, чем двойной спирали ДНК (Лекция 3).
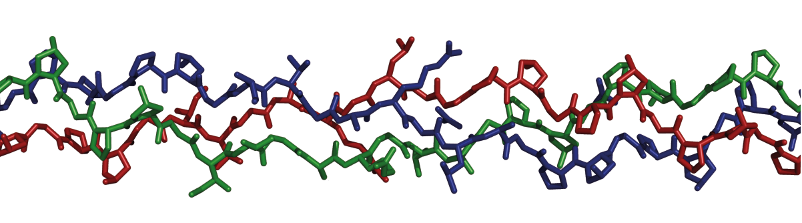
Рис. 2.15. Полипролиновая спираль – структура коллагена. PDB код 1BKV
Третичная структура
Третичная структура белка является результатом слабых нековалентных (за исключением дисульфидных связей) взаимодействий между аминокислотами в полипептидной цепи. К ним относятся водородные связи, ионные и гидрофобные взаимодействия (рис. 2.16). Из всех этих трех типов основной вклад в образование глобулы вносят гидрофобные взаимодействия. На втором месте располагаются водородные связи.
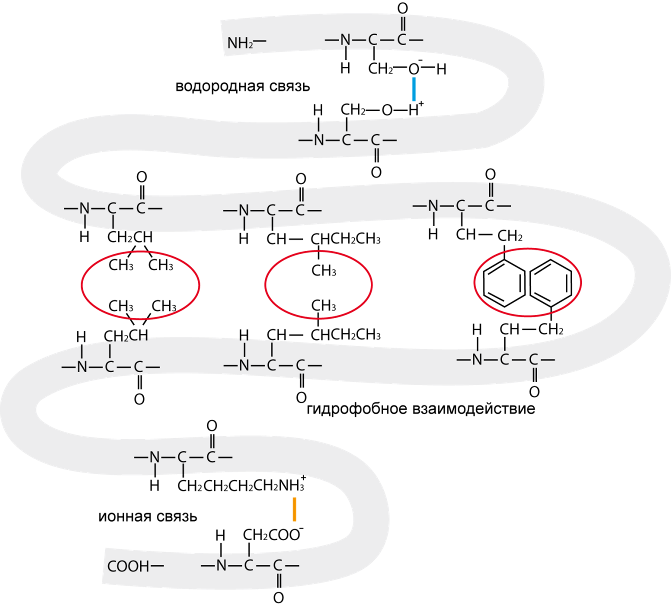
Рис. 2.16. Демонстрация трех типов слабых взаимодействий, формирующих третичную структуру белка: водородные связи, ионные связи и гидрофобные взаимодействия
Изображение белковых структур
Структура белка может быть изображена различными способами. Изображения на рисунке 2.17 базируются на одной и той же структурной модели, полученной с помощью кристаллографических данных. Каждая подчеркивает различные аспекты структурной организации белковой молекулы. В нашем примере белок представляет собой фермент метаболизма, малат дегидрогеназу (malate dehydrogenase), из «галофильного» (живущего в среде с высокой концентрацией соли) организма Haloarcula marismortui.
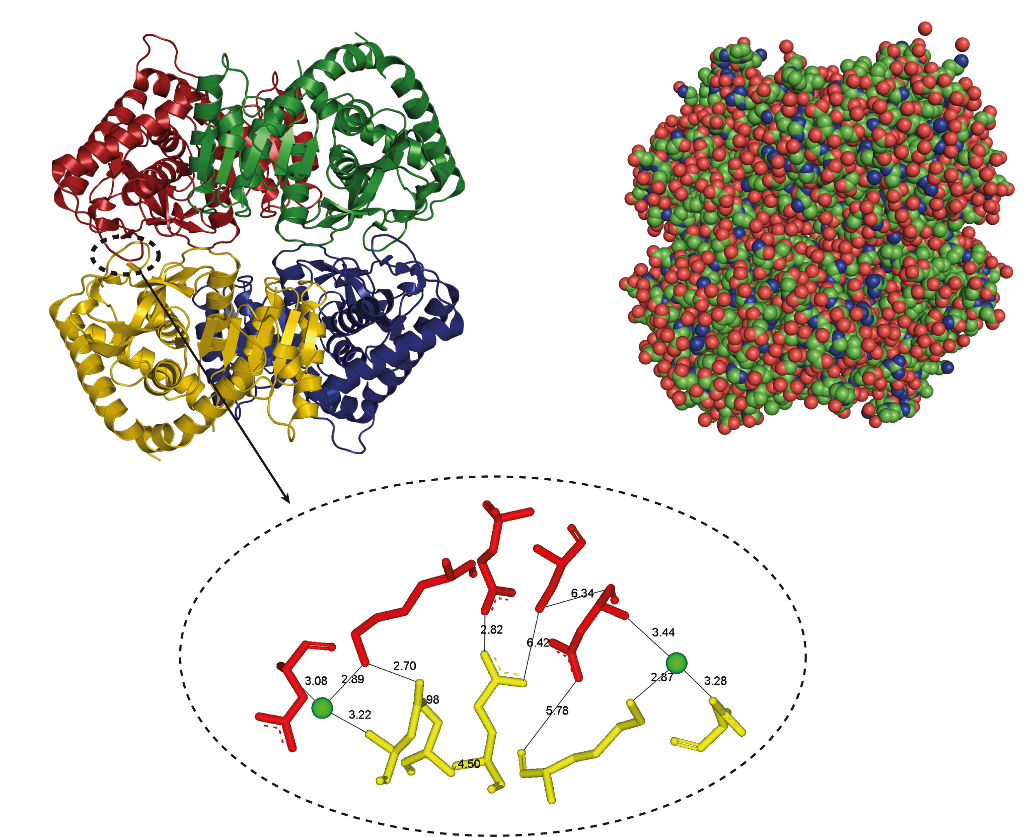
Рис. 2.17. Разные способы изображения одной и той же белковой структуры используются для того, чтобы подчеркнуть ее особенности. Объяснения в тексте. PDB код 1O6Z
Вторичная, третичная и четвертичная структуры белка показаны в верхней части рисунка 2.17, где полипептидная укладка дана в ленточном представлении. Вторичные структуры – это разрешенные локальные конформации цепи, возникающие вследствие химических и стерических ограничений. α-спирали и β-слои показаны, соответственно, как ленточные спирали и стрелки. Представленный белок – тетрамер. Его третичная структура представляет собой трехмерную конформацию субъединицы, а четвертичная структура этого белка образуется за счет объединения субъединиц в тетрамер.
Увеличенный фрагмент белковой структуры, детально иллюстрирующий взаимосвязи различных химических групп, показан в представлении шарики-палочки в нижней части рисунка 2.17. Подобные иллюстрации часто используются, например, для демонстрации взаимодействий в активном центре фермента. В нашем случае картина состоит из множества солевых мостиков (ионных связей между заряженными аминокислотами) и ионных связей с солями растворителя, от которых зависит стабильность белка в присутствии высокой концентрации соли.
В атомном представлении на рисунке 2.17 вокруг каждого атома нарисована Ван-дер-Ваальсова сфера – для более наглядного отображения белковой поверхности. Отрицательно заряженные атомы показаны красным, а положительно заряженные – синим цветом. Поверхность данного белка имеет суммарный отрицательный заряд, что характерно для белков тех организмов, которые адаптированы к высокой концентрации соли.
Как лучше представлять молекулу белка? Ответ в значительной степени зависит от того, на какую особенность структуры мы хотим обратить внимание в белке. На рисунке 2.18 представлена структура гемоглобина в двух представлениях. Первое представление (ленточное) показывает, что мы имеем дело с очень высокоспиральным белком, состоящим из четырех субчастиц-мономеров, каждый из которых окрашен в разные цвета. Второе (линии) – более наглядно показывает, где располагаются функциональные центры, в данном случае порфириновые кольца гемовых групп (окрашены красным).

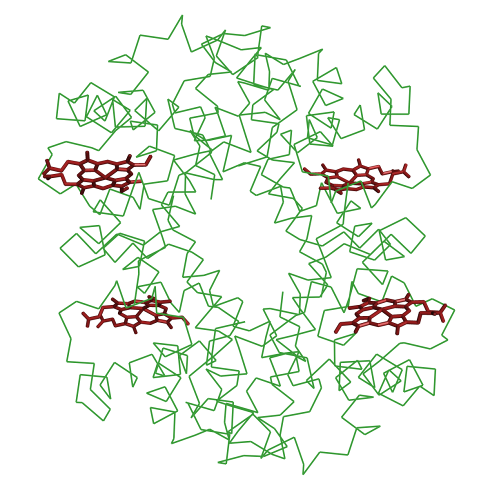
а) б)
Рис. 2.18. Кристаллическая структура гемоглобина человека в двух представлениях: а) ленточном, б) в виде линий. PDB код 1BZ0
