
- •Вопросы к занятию
- •Вопрос 1: Электронное строение карбоксильной группы.
- •Вопрос 2: Кислотность и основность карбоновых кислот с точки зрения протолитической теории.
- •Вопрос 3: Влияние на кислотность карбоновых кислот структуры органического заместителя в молекуле кислоты.
- •Вопрос 4: Классификация, изомерия и номенклатура карбоновых кислот.
- •Вопрос 5: Химические свойства карбоновых кислот. Механизм реакции этерификации.
- •Реакции нуклеофильного замещения. Образование функциональных производных карбоновых кислот
- •Реакции галогенирования с-н кислотного центра радикала
- •Вопрос 6: Хлорангидрнды, ангидриды, амиды и нитрилы производные
- •Вопрос 7: Ди- и трикарбоновые кислоты и особенности их поведения.
- •Вопрос 8: Медико-биологическое значение карбоновых кислот
- •Вопрос 9 Способы получения карбоновых кислот
Методические разработки для преподавателей № 23
Тема: ОСНОВЫ РЕАКЦИОННОЙ СПОСОБНСТИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
КАРБОНОВЫЕ КИСЛОТЫ. ЖИРЫ
Цель: 1.Изучить строение, классификацию, номенклатуру и
изомерию карбоновых кислот.
2. Изучить химические свойства карбоновых кислот и их
производных.
3. Рассмотреть медико-биологическое значение карбоновых
кислот.
ХОД ЗАНЯТИЯ.
1. Организационный момент 5 мин
2. Рассмотрение теоретического материала по теме «Основы реакционной способности органических
соединений. Карбоновые кислоты. Жиры»: 60 мин
Первые три кислоты гомологического ряда (муравьиная, уксусная, пропионовая) – жидкости, хорошо растворимые в воде. Следующие представители – маслянистые жидкости, слабо растворимые в воде. Все жидкие кислоты отличаются своеобразными запахами. Кислоты, начиная с каприновой С9Н19СООН, – твердые вещества, нерастворимые в воде, но растворимые в спирте, эфире. Высокомолекулярные твердые кислоты запаха не имеют. С увеличением молекулярной массы кислот повышается их температура кипения и уменьшается плотность.
Таблица 2
Физические свойства карбоновых кислот
Название |
tпл. °C |
tкип. °C |
p г/см3 |
Раствор-имость (г/100мл H2O;25°C) |
||
кислоты |
её соли (эфиры) |
|||||
муравьиная |
метановая |
формиат |
8,3 |
100,5 |
1,22 |
∞ |
уксусная |
этановая |
ацетат |
16,8 |
118 |
1,05 |
∞ |
пропионовая |
пропановая |
пропионат |
–21 |
141 |
0,99 |
∞ |
масляная |
бутановая |
бутират |
–6 |
164 |
0,96 |
∞ |
валериановая |
пентановая |
валерат |
–34 |
187 |
0,94 |
4,97 |
капроновая |
гексановая |
гексанат |
–3 |
205 |
0,93 |
1,08 |
каприловая |
октановая |
октаноат |
17 |
239 |
0,91 |
0,07 |
каприновая |
декановая |
деканоат |
32 |
269 |
0,89 |
0,015 |
акриловая |
пропеновая |
акрилат |
13 |
|
1,05 |
|
бензойная |
бензойная |
бензоат |
122 |
250 |
1,27 |
0,34 |
щавелевая |
этандиовая |
оксалат |
189,5 с разп. |
|
1,65 |
|
пальмитиновая |
гексадекановая |
пальмитат |
63 |
219 (17мм) |
|
0,0007 |
стеариновая |
октадекановая |
стеарат |
70 |
383 |
|
0,0003 |
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
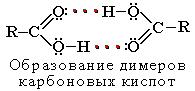
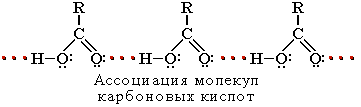
С увеличением молекулярной массы растворимость кислот в воде уменьшается. Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных –COOH.
Кислый вкус плодов и листьев многих растений обусловлен присутствием различных карбоновых кислот – веществами, в состав которых входит одна или несколько карбоксильных групп.
У древних греков представление о кислом вкусе связывалось, прежде всего, с уксусом – раствором уксусной кислоты, образующейся при скисании вина. Само слово «уксус», или, как говорили жители Эллады, «окис», означало «кислый». Получение уксуса при сухой перегонке – нагревании без доступа воздуха – древесины описано в сочинениях Иоганна Глаубера и Роберта Бойля. Однако природа этого вещества вплоть до XIX в. оставалась неизвестна. Лишь в 1814 г. Якоб Берцелиус определил состав уксусной кислоты, а в 1845 г. Немецкий химик Адольф Вильгельм Герман Кольбе (1818-1884) осуществил полный ее синтез из угля. Простейшую из карбоновых кислот – муравьиную кислоту НСООН, впервые получил в 1670 г. английский естествоиспытатель Джон Рей, нагревая муравьев в перегонной колбе. Муравьиная кислота обладает сильными бактерицидными свойствами. Поэтому ее водные растворы используют как пищевой консервант, а парами дезинфицируют тару для продовольственных товаров (в том числе винные бочки), уничтожают пчелиных клещей. Слабый водно-спиртовой раствор муравьиной кислоты (муравьиный спирт) применяют в медицине для растираний. В природе широко распространены и более сложные по составу кислоты. Такова, например, масляная кислота СН3(СН2)2СООН, которая образуется при прогоркании сливочного масла – это из-за нее испорченное масло так неприятно пахнет и горчит. Она обуславливает и запах пота. Родственная ей капроновая кислота СН3(СН2)4СООН входит в состав козьего масла. В корнях растения валерианы содержится некоторое количество изовалериановой кислоты (СН3)2СН–СН2СООН – ее можно выделить, обработав высушенные корни растения перегретым водяным паром.
Высшие кислоты, например стеариновая СН3(СН2)СООН и пальмитиновая СН3(СН2)14СООН, впервые выделенная из пальмового масла, представляют собой бесцветные твердые вещества, не растворимые в воде. Долгое время основным их источником были природные жиры, например свиное сало или говяжий жир. Сейчас эти кислоты получают и синтетически – каталитическим окислением углеводородов нефти. Практическое значение имеют главным образом натриевые соли этих кислот – стеарат натрия С17Н35COONa, и пальмитат натрия – C15H31COONa: они являются основными компонентами мыла.
В щавеле, а также в ревене, кислице, шпинате содержится щавелевая кислота НООС–СООН. Эта простейшая двухосновная кислота – продукт распада некоторых аминокислот, например глицина. При нарушениях обмена веществ (в частности при недостатке витамина В12) в организме человека откладывается ее малорастворимая соль – оксалат кальция, это и есть так называемое оксалатное отложение солей. Янтарная кислота НООС–СН2СН2 –СООН впервые была выделена алхимиками. Еще Агрикола наблюдал при прокаливании янтаря образование похожего на соль белого налета янтарной кислоты (лат.sal succini volatile – «летучая янтарная соль»).
Вопросы к занятию
Вопрос 1: Электронное строение карбоксильной группы.
Карбоксильная группа представляет собой р,π – сопряженную систему, возникающую в результате взаимодействия р-орбитали атома кислорода гидроксильной группы с р-орбиталью атома углерода карбоксильной группы:
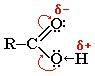
В карбоновых кислотах атом кислорода карбонильной группы смещает к себе электронную плотность от атомов кислорода гидроксильной группы, увеличивая полярность связи в группе O–H, а следовательно, легкость отрыва атома водорода.
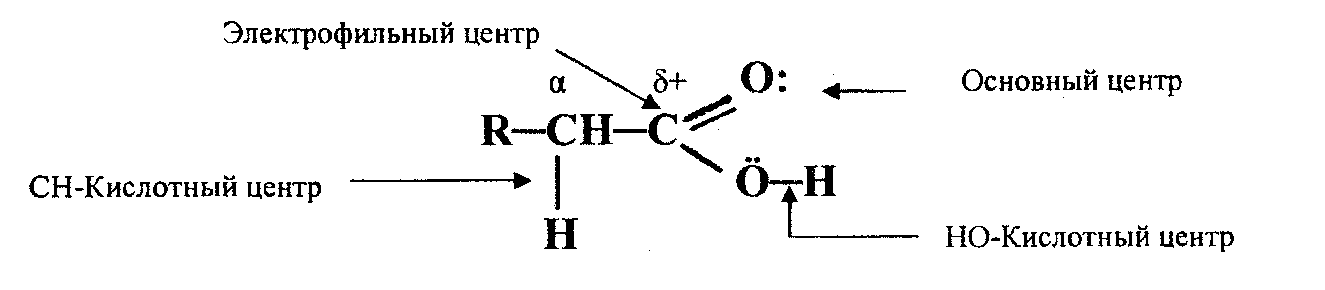
В карбоновых кислотах можно выделить несколько реакционных центров:
–ОН – кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями;
–электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения;
-основный центр – оксогруппа с неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения, чем активирует электрофильный центр молекулы;
–СН- кислотный центр – возникающий у α – атома углерода за счет индуктивного эффекта карбоксильной группы.
Вопрос 2: Кислотность и основность карбоновых кислот с точки зрения протолитической теории.
Диссоциация кислот.Карбоновые кислоты, вследствие большой полярности и поляризуемости связи О–Н, проявляют кислотные свойства. В водных растворах происходит диссоциация этой связи с образованием протона и аниона (карбоксилат-аниона):
![]()
Степень диссоциации карбоновых кислот различна. Самой сильной кислотой является муравьиная, в которой карбоксил не связан с радикалом. Степень диссоциации органических кислот по сравнению с неорганическими значительно меньшая. Поэтому они являются слабыми кислотами, но обладают более сильными кислотными свойствами, чем спирты и фенолы. Это объясняется влиянием карбонильной группы. Анион карбоксильной группы более стабилен, чем алкокси-анион, за счет сопряжения. В карбоксилат-анионе происходит полная делокализация π-электронной плотности, вследствие чего отрицательный заряд распределен поровну между двумя атомами кислорода:
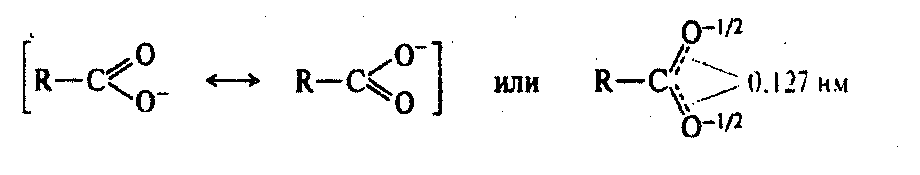
Вопрос 3: Влияние на кислотность карбоновых кислот структуры органического заместителя в молекуле кислоты.
Ответ:
На кислотные свойства карбоновых кислот оказывает влияние строение органического радикала. Электроноакцепторные заместители оттягивают электронную плотность на себя, способствуя повышению частичного положительного заряда на атоме углерода, и усиливают кислотные свойства карбоновых кислот. Электронодонорные заместители – ослабляют кислотные свойства карбоновых кислот, т.к. снижают заряд на карбоксильном атоме углерода. Например, в предложенном ряду понижение кислотных свойств происходит следующем порядке:
СН2Сl – COOH > CH3 – COOH > CH3 – CH2 – COOH
Органические кислоты, так же как и неорганические, дают характерные реакции на индикаторы.
Константы диссоциации карбоновых кислот
Формула кислоты |
Ka (при 25°С) |
HCOOH |
1,77.10-4 |
CH3COOH |
1,7.10-5 |
CH3CH2COOH |
1,64.10-5 |
CH3(CH2)2COOH |
1,54.10-5 |
CH3(CH2)3COOH |
1,52.10-5 |
CH3(CH2)4COOH |
1,43.10-5 |
CH3(CH2)6COOH |
1,28.10-5 |
CH3(CH2)8COOH |
1,43.10-5 |
C6H5COOH |
1,43.10-5 |
НООС–COOH |
K1=5,9.10-2 K2=6,4.10-5 |
CH3(CH2)14COOH |
3,46.10-7 |
