- •Учебно-методическая разработка для студентов, обучающихся по специальности 030503.52 Правоведение среднего профессионального образования
- •Оглавление
- •Пояснительная записка
- •Основные понятия термодинамики
- •Изопроцессы в газах
- •Идеальный газ
- •Изотермический процесс
- •Изохорный процесс
- •Изобарный процесс
- •Второй закон термодинамики
- •Энтропия
- •Примеры решения задач
Изотермический процесс
Если в некотором процессе не изменяются масса и температура газа, то такой процесс называется изотермическим.
График изотермического процесса называется изотермой. Изотерма, изображенная в прямоугольной системе координат (P – V), по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его объем, является гиперболой (рис.3).
Изотерма, изображенная в прямоугольной системе координат (V – T), является прямой, параллельной оси ординат (рис.4).
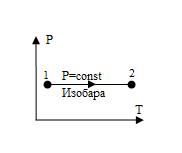
Изотерма, изображенная в прямоугольной системе координат (P – T), является прямой, параллельной оси ординат (рис.5).
При m = const T = const PV = const
Графики изотермического процесса изображаются так:
Рис.3
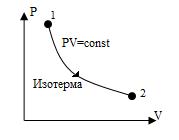
Рис.4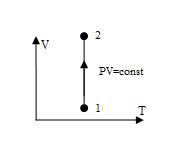
Рис.5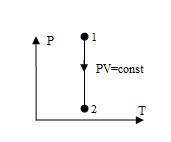
Изохорный процесс
Изохорным процессом называется процесс, протекающий при постоянном объёме (V = const) и при условии m = const и М = const.
При этих условиях из уравнения состояния идеального газа для двух значений температуры Т0 и Т следует:
P0V = m RT0
РV = МRT или Р / Р0 = Т / Т0
Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется. При P1 / P2 = T1 / T2 (это уравнение называется законом Шарля), оно применимо для изохорного процесса: V =const.
Это уравнение изохорного процесса.
Если V — объем газа при абсолютной температуре Т, V0 — объем газа при температуре 00 С; коэффициент а, равный 1/273 K-1, называемый температурным коэффициентом объемного расширения газов, то уравнение для изохорного процесса можно записать как P = P0 × a ×T.
График уравнения изохорного процесса называется изохорой.
Изохора, изображенная в прямоугольной системе координат (P – V), по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его объем, является прямой, параллельной оси ординат (рис.6).
Изохора, изображенная в прямоугольной системе координат (V – T), является прямой, параллельной оси абсцисс (рис.7).
Изохора, изображенная в прямоугольной системе координат (P – T), по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его абсолютная температура, является прямой, проходящей через начало координат (рис.8).
Экспериментальным путем зависимость давления газа от температуры исследовал французский физик Жак Шарль в 1787г.
Изохорный процесс можно осуществить, например нагреванием воздуха при постоянном объеме.
Графики изохорного процесса изображаются так:
Рис. 6
Рис. 7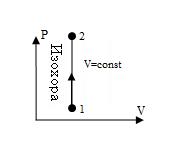
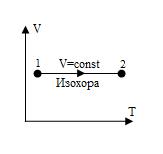
Рис. 8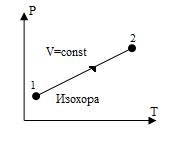
Изобарный процесс
Изобарным процессом называется процесс, протекающий при неизменном давлении P и условии m = const и М = const.
Если в некотором процессе не изменяются масса и давление газа, то уравнение Менделеева-Клапейрона для начального и конечного состояний будет:
P1V1 = RT1
и
P2V2 = RT2
При m = const P = const V / T = const или V1 / V2 = T1 / T2 (уравнение называется законом Гей-Люссака).
Таким же способом, как это было сделано для изохорного процесса, можно получить для изобарного процесса уравнение: Р = соnst.
График уравнения изобарного процесса называется изобарой.
Изобара, изображенная в прямоугольной системе координат (P – V), по оси ординат которой отсчитывается давление газа, а по оси абсцисс — его объем, является прямой, параллельной оси абсцисс (рис. 9).
Изобара, изображенная в прямоугольной системе координат (V – T), является прямой, проходящей через начало координат (рис. 10).
Изобара, изображенная в прямоугольной системе координат (P – T), является прямой, параллельной оси абсцисс (рис. 11).
Экспериментальное исследование зависимости объема газа от температуры провел в 1802г. французский физик Жозеф Г е й-Люссак.
Изобарный процесс происходит, например, при нагревании или охлаждении воздуха в стеклянной колбе, соединенной со стеклянной трубкой, отверстие в которой закрыто небольшим столбом жидкости.
Графики изобарного процесса изображаются так:
Рис. 9
Рис. 10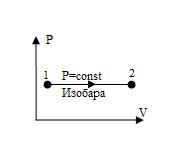
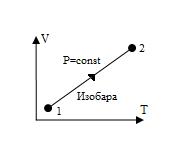
Рис. 11