
Лекция 1 предмет и значение химии
1. Предмет химии. Среди естественных наук, определяющих фундамент инженерных знаний, химия занимает лидирующее положение ввиду своей информационной значимости. Около четверти всего объема научно-технической информации, как известно, составляет – химическая.
Современное определение химии: система химических наук (органическая, неорганическая, аналитическая, физическая химия и т.д.), главной задачей которых является изучение химических процессов (реакций) образования и разрушения молекул (химическая связь), а также взаимосвязей и переходов между этими процессами и другими формами движениями материи (электромагнитные поля и излучения и т.д.).
Химия изучает состав, структуру веществ органического и неорганического происхождения, способности веществ к взаимодействию и явления перехода химической энергии в тепловую, электрическую, световую и др.
Значение химии в существовании и развитии человечества огромно. Достаточно сказать, что ни одна отрасль производства не обходится без химии. Если посмотреть на то, что окружает человека в быту или на работе, – это все дары и деяния химии. О значении химии в различных отраслях промышленности, сельского хозяйства и медицине написаны целые книги. Известный английский физик У. Рамзай сказал: «Та нация, та страна, которая превзойдет другие в развитии химии, превзойдет их в общем материальном благосостоянии».
2. Место химии среди естественных и технических наук. Химия относится к естественным наукам и тесно связана с физикой, биологией, экологией, это одна из наук о природе, а если мыслить философскими категориями – это наука о материи. Известны две основные формы существования материи – вещество и поле. Химия изучает вещество, химическую форму движения материи – превращение одних веществ в другие. Можно дать такое определение химии – это наука о составе, структуре, свойствах веществ, их превращениях и явлениях, сопровождающих эти превращения. Дифференциация и интеграция научных знаний выделили целый ряд химических наук и учебных дисциплин: общая, неорганическая, органическая, аналитическая, физическая химия – с одной стороны; биохимия и экология – с другой стороны.
Основные прикладные задачи химии:
1. Химия обеспечивает сырьевой базой развитие различных отраслей производства. Дальнейший технический прогресс связан с новейшими материалами и технологиями.
2. Современные технологии требуют использования особо чистых, а полупроводниковая техника – сверхчистых материалов. Разработкой методов получения веществ высокой степени очистки также занимается химия.
3. Задачей химии является создание новых химических источников тока, оснащение ими электромобилей.
4. Проблемы экологической защиты человечества и планеты Земля также стоят перед химиками. Это разработка достоверных методов контроля за выбросами в окружающую среду, создание безотходных технологий, замена токсичных веществ и т.д.
Основные законы химии
1. Атомно-молекулярное учение – теоретический фундамент химии.
Вещество – одна из форм существования материи. Вещество состоит из отдельных мельчайших частиц – молекул, атомов, ионов, которые в свою очередь обладают определенным внутренним строением. Говоря иначе, всякое вещество не является чем-то сплошным, а состоит из отдельных очень малых частиц, в основе атомно-молекулярного учения лежит принцип дискретности (прерывности строения) вещества. Свойства веществ являются функцией состава и строения образующих его частиц. Для большинства веществ эти частицы представляют собой молекулы.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Молекулы в свою очередь состоят из атомов. Атом – наименьшая частица элемента, обладающая его химическими свойствами.
Необходимо различать понятия «простое (элементарное) вещество» и «химический элемент». В самом деле, каждое простое вещество характеризуется определенными физическими и химическими свойствами. Когда какое-нибудь простое вещество вступает в химическую реакцию и образует новое вещество, оно утрачивает большинство своих свойств. Например, железо, соединяясь с серой, теряет металлический блеск, ковкость, магнитные свойства и др. Точно так же водород и кислород, входящие в состав воды, содержатся в воде не в виде газообразных водорода и кислорода с их характерными свойствами, а в виде элементов – водорода и кислорода. Если же эти элементы находятся в «свободном состоянии», т.е. не связаны химически ни с каким другим элементом, то они образуют простые вещества. Химический элемент можно определить как вид атомов, характеризующийся определенной совокупностью свойств. При соединении друг с другом атомов одного и того же элемента образуются простые вещества, сочетание же атомов различных элементов дает или смесь простых веществ, или сложное вещество.
Существование химического элемента в виде нескольких простых веществ называется аллотропией. Различные простые вещества, образованные одним и тем же элементом, называются аллотропическими видоизменениями этого элемента. Разница между простым веществом и элементом становится особенно ясным, когда встречаются с несколькими простыми веществами, состоящими из одного и того же элемента. Различают аллотропию состава и аллотропию формы. Атомы одного и того же элемента, расположенные в разном геометрическом порядке (аллотропия формы) или соединяющиеся в молекулы различного состава (аллотропия состава), образуют простые вещества с разными физическими свойствами при похожих химических свойствах. Примерами могут служить: кислород и озон, алмаз и графит.2. Стехиометрические законы. Химический эквивалент. Основу атомно-молекулярного учения составляю основные законы химии, открытые на рубеже XVIII и XIX вв.
Закон сохранения масс и энергий, является основным законом естествознания. Впервые он был сформулирован и экспериментально обоснован М.В. Ломоносовым в 1756-59 гг., позднее он был открыт и подтвержден А.Л. Лавуазье: масса образовавшихся продуктов реакции равна массе исходных реагентов. В математической форме это можно записать:
 (2.1)
(2.1)
где i, j – целые числа, равные числу реагентов и продуктов.
В современном виде этот закон формулируют следующим образом: в изолированной системе сумма масс и энергий постоянна. На законе сохранения массы основаны изучение реакций между отдельными веществами и количественный химический анализ.
Закон взаимосвязи массы и энергии (А. Эйнштейн). Эйнштейн показал, что между энергией и массой существует взаимосвязь, количественно выражаемая уравнением:
Е = mc2 или m = Е/c2 (2.2)
где Е – энергия; m – масса; с – скорость света. Закон справедлив для ядерных реакций, в которых выделяется огромное количество энергии при небольших изменениях масс (атомный взрыв).
Закон постоянства состава (Ж.Л. Пруст, 1801-1808): каким бы путем не было получено данное химически чистое соединение, состав его является постоянным. Так, оксид цинка может быть получен в результате самых разнообразных реакций:
Zn + 1/2 O2 = ZnO; ZnСO3 = ZnO + СO2; Zn(OН)2 = ZnO + Н2О.
Но в химически чистом образце ZnO всегда содержится 80,34% Zn и 19,66% О.
Закон постоянства состава полностью выполняется для газообразных, жидких и ряда твердых веществ (дальтониды), однако многие кристаллические вещества сохраняют свою структуру при переменном (в некоторых пределах) составе (бертоллиды). К ним относятся соединения некоторых металлов друг с другом, отдельные оксиды, сульфиды, нитриды. Следовательно, этот закон применим лишь для таких веществ, которые независимо от агрегатного состояния имеют молекулярную структуру. В соединениях переменного состава этот закон имеет границы применимости, в особенности для веществ, находящихся в твердом состоянии, так как носителем свойств в данном состоянии является не молекула, а некая совокупность ионов разных знаков, называемая фазой (однородная часть неоднородной системы, ограниченная поверхностью раздела), или, говоря иначе кристаллические решетки твердых тел имеют дефекты (вакансии и включения узлов).
Закон эквивалентов (Рихтер, 1792-1800): химические элементы соединяются между собой в массовых отношениях, пропорциональных их химическим эквивалентам:
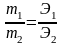 . (2.3)
. (2.3)
На основании этого закона проводятся все стехиометрические расчеты.
Химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 молем (1,008 г) атомов водорода или замещает то же количество атомов водорода в химических соединениях.
Понятие об эквивалентах и эквивалентных массах распространяется также на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества.
Расчет эквивалентов простых и сложных веществ:
 (2.4)
(2.4)
 (2.5)
(2.5)
 (2.6)
(2.6)
 (2.7)
(2.7)
 (2.8)
(2.8)
где Ar – атомная масса элемента; МА – молекулярная масса соединения.
Закон кратных отношении (Д. Дальтон, 1808). Если два элемента образуют между собой несколько химических соединений, то количество одного из них, отнесенное к одному и тому же количеству другого, относятся как небольшие целые числа.
Поясним содержание закона на примере анализа соединений азота с кислородом: N2O, NO, N2O3, NO2, N2O5. Атомная масса азота 14, кислорода – 16. Количество кислорода, пошедшего на образование оксидов по отношению к 14 г азота: 8:16:24:32:40=1:2:3:4:5.
Закон Авогадро (1811). Это один из основных законов химии: в равных объемах газов при одинаковых физических условиях (давлении и температуре) содержится одинаковое число молекул.
А. Авогадро установил, что молекулы газообразных веществ двухатомны, не H, О, N, Cl, а H2, О2, N2, Cl2. Однако с открытием инертных газов (они одноатомны) обнаружилось исключения.
Первое следствие: 1 моль любого газа при нормальных условиях имеет объем, равный 22,4 л.
Второе следствие: плотности любых газов относятся как их молекулярные массы: d1/d2=M1/M2.
Постоянная Авогадро – число частиц, в 1 моле вещества 6,021023 моль-1.
Объяснение основных законов химии в свете атомно-молекулярной теории лежит в ее постулатах:
1) атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части (химическими способами) или превратить друг в друга, или уничтожить;
2) все атомы одного элемента одинаковы и имеют одинаковую массу (если не учитывать существования изотопов, см. лекцию 3);
3) атомы различных элементов имеют разные массы;
4) при химической реакции между двумя или большим числом элементов их атомы соединяются друг с другом в небольших целочисленных отношениях;
5) относительные массы элементов, которые соединяются друг с другом, непосредственно связаны с массами самих атомов, т.е. если 1 г серы соединяется с 2 г меди, то это значит, что каждый атом меди весит вдвое больше, чем атом серы;
Одним словом химией «управляют» целые числа, поэтому все эти законы называют стехиометрическими. В этом заключено торжество атомно-молекулярного учения.
3. Атомные и молекулярные массы. Моль. Рассмотрим в каких единицах выражают молекулярные и атомные массы. В 1961 г. принята единая шкала относительных атомных масс, в основу которой положена 1/12 часть массы атома изотопа углерода 12С, названная атомной единицей массы (а.е.м.). В соответствии с этим в настоящее время относительной атомной массой (атомной массой) элемента называют отношение массы его атома к 1/12 части массы атома 12С.
Аналогично относительной молекулярной массой (молекулярной массой) простого или сложного вещества называют отношение массы его молекулы к 1/12 части массы атома 12С. Поскольку масса любой молекулы равна сумме масс составляющих ее атомов, то относительная молекулярная масса равна сумме соответствующих относительных атомных масс. Например, молекулярная масса воды, молекула которой содержит два атома водорода и один атом кислорода, равна: 1,00792+15,9994= 18,0152.
Наряду с единицами массы и объема, в химии пользуются также единицей количества вещества, называемой молем. Моль – количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
Количество вещества в молях равно отношению массы вещества m к его молекулярной массе M:
= m/М. (2.8)
Молярную массу (М) обычно выражают в г/моль. Молярная масса вещества, выраженная в г/моль, имеет то же численное значение, что и его относительная молекулярная (атомная) масса. Так, мольная масса атомарного водорода равна 1,0079 г/моль, молекулярного водорода – 2,0158 г/моль.
Зависимость объема газа от давления и температуры может быть описана уравнением состояния идеального газа pV = RT, справедливым для одного моля газа, а с учетом числа молей оно становится знаменитым уравнением Клапейрона – Менделеева:
pV=RT (2.9)
где R – универсальная газовая постоянная (8,31 Дж/мольК).
С помощью этого уравнения и второго следствия из закона Авогадро, используя простые измерительные приборы (термометр, барометр, весы), в конце XIX в. были определены молекулярные массы многих летучих простых и сложных органических и неорганических веществ. В 1860 г. на I Международном конгрессе химиков (Карлсруэ, Германия) были приняты классические определения основных понятий: атома, молекулы, элемента и т.д., проведена систематика, классификация основных типов реакций и классов химических соединений.
4. Основные классы неорганических соединений. Классификация простых и сложных химических веществ основана на рассмотрении реагентов и продуктов одной из основных химических реакций – реакции нейтрализации. Основы этой классификации были заложены И.Я. Берцелиусом в 1818 г., в дальнейшем она была существенно уточнена и дополнена.
Еще алхимики объединили ряд простых веществ, обладающих похожими физическими и химическими свойствами, под названием металлы. Типичным металлам свойственны ковкость, металлический блеск, высокая тепло- и электропроводность, по химическим свойствам металлы являются восстановителями. Остальные простые вещества были объединены в класс неметаллов (металлоидов). Неметаллы отличаются более разнообразными физическими и химическими свойствами. При взаимодействии простых веществ с кислородом образуются оксиды. Металлы образуют основные оксиды, неметаллы – кислотные. В реакции таких оксидов с водой образуются, соответственно, основания и кислоты. Наконец, реакция нейтрализации кислот и оснований приводит к образованию солей. Соли также могут получаться при взаимодействии основных оксидов с кислотными оксидами или кислотами, кислотных оксидов – с основными оксидами или основаниями (табл. 1).
Таблица 1
Химические свойства основных классов неорганических соединений
|
Металл |
Основной оксид |
Основание |
Соль |
Неметалл |
Fe + S =FeS |
— |
2NaOH + Cl2 = NaCl + NaClO+H2O |
2NaBr + Cl2 = 2NaCl + Br2 |
Кислотный оксид |
— |
CaO + CO2 = CaCO3 |
2NaOH + CO2 = Na2CO3 + H2O |
— |
Кислота |
Fe + 2HCl = FeCl2 + H2 |
CaO + H2SO4 = CaSO4 + H2O |
NaOH + HCl = NaCl + H2O |
BaCl2 + H2SO4 = BaSO4↓ + 2HCl |
Соль |
Zn + CuSO4= Cu + ZnSO4 |
— |
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 |
AgNO3 + NaCl = AgCl↓ + NaNO3 |
Следует подчеркнуть, что с водой непосредственно реагируют только те основные оксиды, которые образуют растворимые в воде основания – щелочи. Нерастворимые в воде основания (например, Cu(OH)2) могут быть получены из оксидов только в две стадии:
CuO + H2SO4 = CuSO4 + H2O, CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4.
Классификация оксидов не исчерпывается основными и кислотными. Ряд оксидов и соответствующих им гидроксидов проявляют двойственные свойства: реагируют с кислотами как основания и с основаниями как кислоты (в обоих случаях образуются соли). Такие оксиды и гидроксиды называются амфотерными:
Al2O3+6HCl=2AlCl3+3H2O, Al2O3+2NaOH=2NaAlO2+H2O (сплавление тв. вещ-в),
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O, Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] (в р-ре).
Некоторым оксидам невозможно сопоставить соответствующие им кислоту или основание. Такие оксиды называются несолеобразующими, например, оксид углерода (II) CO, оксид азота (I) N2O. Они не участвуют в кислотно-основных взаимодействиях, но могут вступать в другие реакции. Так, N2O – сильный окислитель, CO – хороший восстановитель. Иногда кислотные, основные и амфотерные оксиды объединяют в класс солеобразующих.
Среди кислот выделяются бескислородные – например, хлороводородная (соляная) HCl, сероводородная H2S, циановодородная (синильная) HCN. По кислотно-основным свойствам они не отличаются от кислородсодержащих кислот. Существуют также вещества, обладающие основными свойствами, но не содержащие атомов металла, например, гидроксид аммония NH4OH – производное аммиака NH3.
По числу содержащихся в молекуле кислоты атомов водорода, способных замещаться атомами металла, различают кислоты одноосновные (например, хлороводород НСl, азотистая кислота НNО2), двухосновные (сернистая Н2SО3, угольная Н2СО3), трехоcновные (ортофосфорная Н3РO4).
Названия кислот производят от элемента, образующего кислоту. В случае бескислородных кислот к названию элемента (или группы элементов, например, СN – циан), образующего кислоту, добавляют суффикс «о» и слово «водород»: Н2S – сероводород, НСN – циановодород.
Названия кислородосодержащих кислот зависят от степени окисления кислотообразующего элемента. Максимальной степени окисления элемента соответствует суффикс «...н(ая)» или «...ов(ая)» например, НNО3 – азотная кислота, НСlO4 – хлорная кислота, Н2СrO4 – хромовая кислота. По мере понижения степени окисления суффиксы изменяются в следующей последовательности: «...оват(ая)», «...ист(ая)», «...оватист(ая)»; например, НСlO3 – хлорноватая, НСlO2 – хлористая, НОСl – хлорноватистая кислоты. Если элемент образует кислоты только в двух степенях окисления, то для названия кислоты, соответствующей низшей степени окисления элемента, используется суффикс «...ист(ая)»; например, НNО2 – азотистая кислота. Кислоты, содержащие в своем составе группировку атомов -O-O-, можно рассматривать как производные пероксида водорода. Их называют пероксокислотами (или надкислотами). В случае необходимости после приставки «пероксо» в название кислоты помещают числительную приставку, указывающую число атомов кислотообразующего элемента, входящих в состав молекулы, например: H2SO5, H2S2O8.
Среди соединений важную группу образуют основания (гидроксиды), т.е. вещества, в состав которых входят гидроксильные группы ОН-. Названия гидроксидов образуются из слова «гидроксид» и названия элемента в родительном падеже, после которого, в случае необходимости, римскими цифрами в скобках указывается степень окисления элемента. Например, LiОН – гидроксид лития, Fe(ОН)2 – гидроксид железа (II).
Характерным свойством оснований является их способность взаимодействовать с кислотами, кислотными или амфотерными оксидами с образованием солей, например:
KOH + HCl = KCl + Н2O,
Ва(ОН)2 + СО2 = ВаСО3 + Н2О
2NаОН + Аl2O3 = 2NаАlO2 + Н2О
С точки зрения протолитической (протонной) теории основаниями считают вещества, которые могут быть акцепторами протонов, т.е. способны присоединять ион водорода. С этих позиций к основаниям следует относить не только основные гидроксиды, но и некоторые другие вещества, например аммиак, молекула которого может присоединять протон, образуя ион аммония:
NH3 + H+ = NH4+
Действительно, аммиак, подобно основным гидроксидам, способен реагировать с кислотами с образованием солей:
NН3 + НСl = NH4Сl
В зависимости от числа протонов, которые могут присоединяться к основанию, различают основания однокислотные (например, LiОН, КОН, NН3), двухкислотные [Са(ОН)2, Fе(ОН)2] и т.д.
Амфотерные гидроксиды (Al(ОН)3, Zn(ОН)2) способны диссоциировать в водных растворах как по типу кислот (с образованием катионов водорода), так и по типу оснований (с образованием гидроксильных анионов); они могут быть как донорами, так и акцепторами протонов. Поэтому амфотерные гидроксиды образуют соли при взаимодействии как с кислотами, так и с основаниями. При взаимодействии с кислотами амфотерные гидроксиды проявляют свойства оснований, а при взаимодействии с основаниями – свойства кислот:
Zn(ОН)2 + 2НСl = ZnСl2 + 2Н2О,
Zn(ОН)2 + 2NаОН = Nа2ZnО2 + 2Н2О.
Существуют соединения элементов с кислородом, которые по составу относятся к классу оксидов, но по своему строению и свойствам принадлежат к классу солей. Это так называемые пероксиды, или перекиси. Пероксидами называются соли пероксида водорода Н2О2, например, Nа2О2, СаО2. Характерной особенностью строения этих соединений является наличие в их структуре двух связанных между собой атомов кислорода («кислородный мостик»): -О-О-.
Соли при электролитической диссоциации образуют в водном растворе катион К+ и анион А–. Соли можно рассматривать как продукты полного или частного замещения атомов водорода в молекуле кислоты атомами металла или как продукты полного или частичного замещения гидроксогрупп в молекуле основного гидроксида кислотными остатками.
Реакция нейтрализации может протекать не до конца. В этом случае при избытке кислоты образуются кислые соли, при избытке основания – основные (соли, образующиеся при эквивалентном соотношении, называются средними). Понятно, что кислые соли могут быть образованы только многоосновными кислотами, основные соли – только многокислотными основаниями:
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O,
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O,
2Ca(OH)2 + H2SO4 = (CaOH)2SO4 + 2H2O.
Среди многообразия и огромного количества химических реакций всегда присутствовала их классификация. Так, с учетом развития химии выделяются три основных типа химических реакций:
1) кислотно-основного равновесия, частные случаи – нейтрализации, гидролиза, электролитической диссоциации кислот и оснований;
2) окислительно-восстановительные с изменением степени окисления атома, иона, молекулы. При этом различают стадии окисления и восстановления как части одного процесса отдачи и присоединения электронов;
3) комплексообразования – присоединения определенного числа молекул или ионов к центральному атому или иону металла, который является комплексообразователем, а первые – лигандами, количество которых характеризуется координационным числом (n).
Согласно этим типам химических реакций классифицируются и химические соединения: кислоты и основания, окислители и восстановители, комплексные соединения и лиганды.
В более современной трактовке с учетом электронного строения атомов и молекул, реакции первого типа можно определить как реакции с участием и переносом протона, реакции второго типа – с переносом электрона, реакции третьего типа – с переносом неподеленной пары электронов. Количественной мерой реакций первого типа являются, например, рН, второго – потенциал (E, B), разность потенциалов (Δφ, В), а третьего, – например, реализация определенного координационного числа (n) химических (донорно-акцепторных) связей, энергия стабилизации лигандного поля центрального иона – комплексообразователя (ΔG, кДж/моль), константа устойчивости.
