
- •Контрольные вопросы
- •3.Массопередача в системах с твердой фазой
- •3.1.1.Физические основы адсорбции, основные понятия и определения. Основные виды промышленных адсорбентов и их характеристика
- •3.1.2.Равновесие в процессе адсорбции, материальный баланс, движущая сила и направление протекания процесса.
- •3.1.3.Кинетика и динамика процесса адсорбции, его тепловой эффект, расчет адсорберов
- •3.1.4.Конструкции адсорберов, их устройство и принцип работы.
- •3.2 Ионный обмен
- •3.2.1.Основные термины и физическая сущность ионообменных процессов. Структура и свойства ионитов
- •3.2.2. Механизм и равновесие ионообменного процесса
- •3.2.3. Кинетика и динамика ионного обмена, способы проведения процесса и их расчет, схема ионообменной установки и ее принцип работы
- •3.3.Выщелачивание
- •3.3.1.Физические основы и механизм выщелачивания
- •3.3.2.Способы выщелачивания и аппаратурное оформление процесса
- •3.4.Физические основы кристаллизации, основные понятия и определения, движущая сила процесса, способы ее создания и методы кристаллизации
- •3 .4.1.Равновесие процесса, выбор метода кристаллизации
- •3.4.2.Кинетика кристаллизации
- •3.4.3.Конструкции кристаллизаторов, материальный и тепловой балансы
- •4.Мембранные методы разделения смесей. Физическая сущность, движущая сила и механизмы процессов
- •4.1.Кинетика процессов мембранного разделения смесей. Конструкции аппаратов, материальный баланс, порядок расчета
3.2.3. Кинетика и динамика ионного обмена, способы проведения процесса и их расчет, схема ионообменной установки и ее принцип работы
Описание кинетики ионного обмена сводится к решению задачи ионнообменного равновесия с добавлением уравнения кинетики лимитирующей стадии внешней (или внутренней) диффузии ионов к зоне гетерогенной реакции обмена.
Процесс обмена иона раствора Мe+ с ионом адсорбента H+ на примере реакции
![]() (200)
(200)
в ключает
пять последовательных стадий:
ключает
пять последовательных стадий:
- перемещение вытесняющего иона Мe+ из раствора к поверхности зерна ионита, АС;
- перемещение вытесняющего иона внутри зерна к точке обмена,СD;
- химическая реакция замещения иона, D;
-
перемещение вытесненного иона Н+
внутри зерна от точки обмена к поверхности
раздела фаз,
![]() ;
;
-
перемещение вытесненного иона Н+
от поверхности раздела в раствор,
![]() .
.
Из приведенных стадий 1 и 5, 2 и 4 по своей физической сущности однотипны и отличаются лишь направлением перемещения ионов. Поэтому основными стадиями кинетики протекания процесса являются: стадия химической реакции, характеризующая химическую кинетику; стадия перемещения иона из раствора к поверхности зерна (либо наоборот), характеризующая массоотдачу во внешнедиффузионной области; стадия перемещения иона внутри зерна ионита, характеризующая внутреннюю диффузию.
Задача кинетики химической реакции обмена сформулирована ранее и представлена системой уравнений (198).
Внешнедиффузионная задача перемещения ионов металла Ме+ к поверхности зерна ионита и внешняя диффузия вытесненного иона Н+ полностью аналогичны, причем массовые потоки ионов равны исходя из закона эквивалентности. Скорость процесса во внешнедиффузионной области определяется гидродинамикой жидкой фазы (режимом течения раствора), а уравнение внешней диффузии ионов представляют в виде
![]() ,
(201)
,
(201)
где а – объемная концентрация ионов в ионите, г-экв/м3 адсорбента; С0 – исходная концентрация ионов в растворе, г-экв/м3 раствора; С – концентрация ионов в растворе в момент времени , г-экв/м3 раствора, ж – коэффициент массоотдачи, м/с.
Под внутридиффузионной областью ионного обмена понимают область диффузии ионов внутри зерен адсорбента. Скорость процесса в этой области зависит от структуры зерна, т.е. от его пористости, формы, размеров и описывается уравнением
![]() ,
(202)
,
(202)
где
![]() – обменная емкость ионита, г-экв/м3,
а- концентрация ионов в ионите в момент
времени , г-экв/м3;
т – кинетический
коэффициент, м/с.
– обменная емкость ионита, г-экв/м3,
а- концентрация ионов в ионите в момент
времени , г-экв/м3;
т – кинетический
коэффициент, м/с.
Многочисленные эксперименты по ионному обмену показали, что скорость обменных реакция лимитируется диффузионными процессами: внешней, либо внутренней диффузией. Какой из диффузионных процессов сдерживает процесс ионного обмена определяется индивидуально для каждого вещества путем экспериментального определения кинетических коэффициентов ж и т.
Ионообменные процессы могут проводиться двумя способами:
в статических условиях;
в динамических условиях.
Физическая сущность первого способа заключается в том, что в аппарат периодического действия загружают ионит и раствор. Полученную суспензию перемешивают до насыщения ионита адсорбирующимся веществом.
Динамика периодического процесса заключается в том, что раствор пропускают через неподвижный слой ионита до момента проскока. В непрерывных процессах раствор и движущейся слой ионита подают в колонну противотоком.
Динамический способ обладает преимуществом перед статическим способом, заключающимся в том, что позволяет осуществить более глубокую очистку раствора, вследствие последовательного контакта очищенного раствора со свежими, неотработанными слоями ионита.
Расчет ионообменного процесса в статических условиях проводят следующим образом:
1)рассчитывают количество ионов металла, содержащихся в растворе
![]() ,
(203)
,
(203)
где V - объем очищаемого раствора, м3; С0 – концентрация ионов металла в растворе, г-экв/м3;
2)определяют объемную и массовую загрузку катионита:
![]() ,
(204)
,
(204)
где а0 - обменная емкость катионита, г-экв/м3;нас - насыпная плотность катионита, кг/м3;
3)необходимый объем реакторной установки
![]() ,
(205)
,
(205)
где Vр-ра – объем раствора, м3;
4)количество аппаратов в установке
![]() ,
(206)
,
(206)
где Vап – объем аппарата, м3.
Расчет ионообменного процесса в динамических условиях возможен двумя методами:
экспериментальный метод Н.А. Шилова, основы которого рассмотрены ранее для процесса адсорбции. Для процессов ионного обмена сущность метода заключается в том, что на основании 23 опытов на слоях адсорбента различной высоты определяют коэффициент защитного действия слоя и время формирования фронта адсорбции (К и нас) по уравнению прямой =КН-нас. Полученные данные используют для расчета промышленной установки при условии постоянства объемного расхода;
послойный метод. Сущность метода заключается в том, что ионообменную колонну по высоте разбивают на ряд секций (например, с псевдоожиженным слоем ионита). Ионит и жидкая фаза движутся противотоком, причем полагают, что в каждой секции раствор находится в равновесии с адсорбентом и математическая задача сводится к решению следующих уравнений:
- уравнения баланса по извлекаемому
компоненту для ионообменного аппарата
от его первой секции до n-ой
включительно
уравнения баланса по извлекаемому
компоненту для ионообменного аппарата
от его первой секции до n-ой
включительно
![]() ;
(207)
;
(207)
- уравнения изотермы ионного обмена
 ;
(208)
;
(208)
- уравнение кинетики массопередачи для псевдоожиженного слоя бесконечно малой высоты
 ,
(209)
,
(209)
где Ку,v – объемный коэффициент массопередачи, с-1; Vс - объем псевдоожиженного слоя в каждой секции, м3; Qу - объемный расход раствора, м3/с.
При расчете многосекционных ионообменных колонн необходимо определять концентрацию раствора на выходе из каждой секции. Решение системы уравнений представляют в виде:
 ,
(210)
,
(210)
где
![]() -
константа.
-
константа.
Расчет проводят до достижения необходимой конечной концентрации раствора. Высоту ионообменной колонны Нк определяют исходя из необходимого количества секций
![]() ,
(211)
,
(211)
где n – количество секций в аппарате, Н – высота псевдоожиженного слоя в секции колонны, м.
Устройство и схема ионообменной установки
И
![]()
![]() онообменная
установка периодического действия с
неподвижным слоем ионита состоит из
корпуса 1, опорной решетки 2 с насыпным
слоем гравия и гранулированного ионита
3. Распределительные устройства 4 и 5,
выполненные в виде труб с колпачками
или щелями, предназначены для равномерного
распределения раствора и предотвращения
уноса мелких частиц ионита.
онообменная
установка периодического действия с
неподвижным слоем ионита состоит из
корпуса 1, опорной решетки 2 с насыпным
слоем гравия и гранулированного ионита
3. Распределительные устройства 4 и 5,
выполненные в виде труб с колпачками
или щелями, предназначены для равномерного
распределения раствора и предотвращения
уноса мелких частиц ионита.
![]()
![]() Полный
цикл работы аппарата состоит из следующих
стадий: 1)собственно ионообмена; 2)отмывки
ионита от механических примесей;
3)регенерации ионита; 4)отмывки ионита
от регенерирующего раствора. На первой
стадии раствор поступает через
распределительное устройство 4, проходит
сквозь слой ионита сверху вниз и
удаляется через распределительное
устройство 5. На второй стадии через
устройство 5 подается под давлением
промывная вода, которая проходит через
слой ионита в противоположном направлении
и удаляется через распределительное
устройство 4. Для регенерации отработанного
ионита через распределительное устройство
6 насосом 7 из бака 8 подается регенерируемый
раствор, который движется через слой
ионита в том же направлении, что и
раствор. По окончании стадии регенерации
проводят отмывку ионита от регенерирующего
раствора водой при ее движении сверху
вниз. Ионообменные колонны периодического
действия с неподвижным (или взвешенным)
слоем могут использоваться в виде
батареи колонн в установках непрерывного
действия.
Полный
цикл работы аппарата состоит из следующих
стадий: 1)собственно ионообмена; 2)отмывки
ионита от механических примесей;
3)регенерации ионита; 4)отмывки ионита
от регенерирующего раствора. На первой
стадии раствор поступает через
распределительное устройство 4, проходит
сквозь слой ионита сверху вниз и
удаляется через распределительное
устройство 5. На второй стадии через
устройство 5 подается под давлением
промывная вода, которая проходит через
слой ионита в противоположном направлении
и удаляется через распределительное
устройство 4. Для регенерации отработанного
ионита через распределительное устройство
6 насосом 7 из бака 8 подается регенерируемый
раствор, который движется через слой
ионита в том же направлении, что и
раствор. По окончании стадии регенерации
проводят отмывку ионита от регенерирующего
раствора водой при ее движении сверху
вниз. Ионообменные колонны периодического
действия с неподвижным (или взвешенным)
слоем могут использоваться в виде
батареи колонн в установках непрерывного
действия.
Ионообменные колонны непрерывного действия с движущимся и кипящим слоем ионита аналогичны конструкциям адсорберов, рассмотренных выше. В этом случае скорость жидкости через колонну больше скорости начала псевдоожижения частиц ионита. На каждой тарелке ионит находится во взвешенном состоянии, через переливные патрубки перетекает с тарелки на тарелку и с нижней тарелки отводится на регенерацию. При проведении непрерывных процессов отдельные его стадии осуществляются в отдельных аппаратах.
В химической технологии
непрерывную ионообменную очистку в
кипящем слое проводят с помощью нескольких
последовательно соединенных п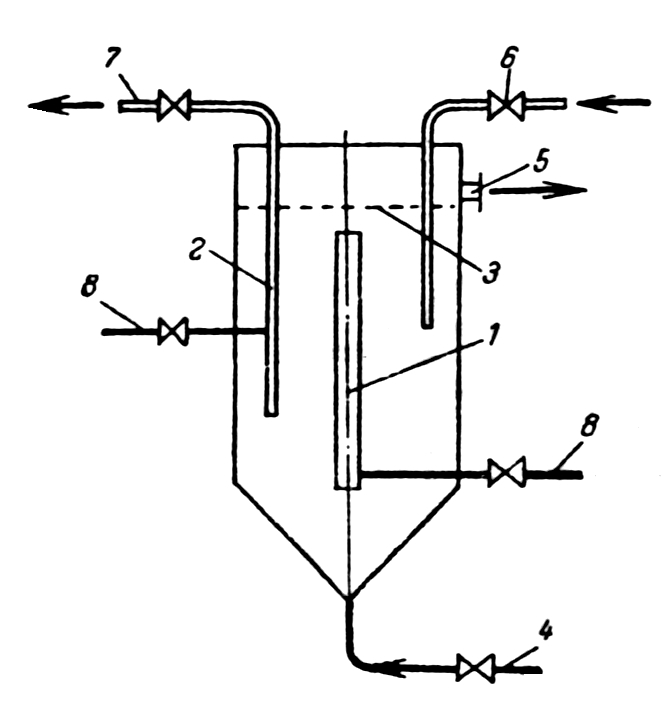 олых
колонн с пневматическим перемешиванием.
В каждой колонне подача исходной пульпы
осуществляется через трубу 4. За счет
нагнетания сжатого воздуха, подаваемого
в центральную трубу 1, достигается
эрлифтный эффект и интенсивная циркуляция
пульпы. Отвод отработанной пульпы
осуществляется через штуцер 5. Труба 6
предназначена для подачи ионита, элифтное
устройство 2,7 – для транспортировки
ионита на следующую ступень каскадной
установки за счет подачи сжатого воздуха
через трубу 8.
олых
колонн с пневматическим перемешиванием.
В каждой колонне подача исходной пульпы
осуществляется через трубу 4. За счет
нагнетания сжатого воздуха, подаваемого
в центральную трубу 1, достигается
эрлифтный эффект и интенсивная циркуляция
пульпы. Отвод отработанной пульпы
осуществляется через штуцер 5. Труба 6
предназначена для подачи ионита, элифтное
устройство 2,7 – для транспортировки
ионита на следующую ступень каскадной
установки за счет подачи сжатого воздуха
через трубу 8.
Контрольные вопросы
1.Физическая сущность адсорбции, виды промышленных адсорбентов и их характеристика.
2.Равновесие при адсорбции, виды изотерм равновесия и их характеристика, движущая сила и направление протекания процесса.
3.Материальный баланс непрерывной и периодической адсорбции.
4.Механизм и кинетика адсорбции.
5.Основные типы промышленных адсорберов, их устройство и принцип работы.
6.Физические основы ионообмена: понятие катиона, аниона, ионитов. Структура ионитов, типичные реакции ионного обмена.
7.Основные свойства ионитов.
8.Рановесие при ионном обмене, его математическое описание.
9.Кинетика ионообмена, характеристика способов осуществления процесса.
10.Ионообменные установки, устройство и принцип работы.
