
- •Задача 1
- •Задача 2
- •Задача 3
- •Задача 4
- •Задача 5
- •Задача 6
- •Задача 7
- •Задача 8
- •Задача 9
- •Задача 10
- •Задача 11
- •Задача 12
- •Задача 13
- •Задача 14
- •Задача 15
- •Частные реакции на сульфацил-натрия:
- •Задача 16
- •Задача 17
- •Задача 18
- •Задача 20
- •Задача 21
- •Задача 22
- •Задача 23
- •Задача 24
- •Количественное определение
- •Задача 28
- •Задача 30
- •Задача 31
- •Задача 32
- •Задача 33
- •Задача 34
- •Задача 35
- •Задача 36
- •Задача 37
- •Задача 38
- •Задача 39
- •Задача 40
Задача 10
NaCI - Natrii chloridum; KCI - Kalii chloridum; CaCI2 - Calcii chloridum;
NaHCO3 - Natrii hydrocarbonas; H2O - Aqua purificata pro injectionibus
1. Растворы натрия хлорида и калия хлорида относятся к группе солевых плазмозаменяющих лекарственных средств, влияющих на тканевой обмен. Для нормальной деятельности сердца необходим баланс ионов калия и натрия.
Кальция хлорид применяют для повышения свертываемости крови, как противовоспалительное, противоаллергическое средство.
Натрия гидрокарбонат относится к препаратам, применяемым для коррекции кислотно-щелочного и ионного равновесия в организме. Применяют при различных заболеваниях, сопровождающихся выраженным ацидозом, наружно для полосканий, промываний (0,5-2%) растворы.
Раствор Рингера применяется в качестве солевого плазмозаменяющего раствора.
Катион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет, катион калия окрашивает пламя в фиолетовый цвет, катион кальция – в кирпично-красный. Для идентификации указанных катионов в растворе Рингера применяют химические реакции.
К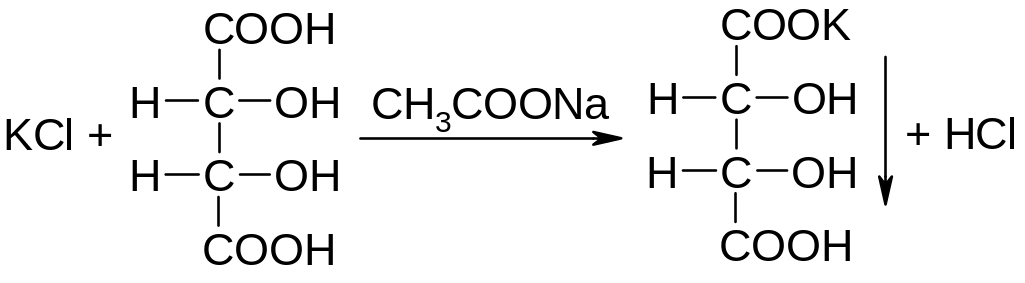 атион
калия обнаруживают реакцией с винной
кислотой по образованию белого
кристаллического осадка, растворимого
в минеральных кислотах:
атион
калия обнаруживают реакцией с винной
кислотой по образованию белого
кристаллического осадка, растворимого
в минеральных кислотах:
Соли калия в уксуснокислой среде образуют с гексанитрокобальтатом (III) натрия желтый кристаллический осадок:
2KCl ++ Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2NaCl
Катионы натрия можно обнаружить по зеленовато-желтому кристаллическому осадку с цинкуранилацетатом в уксуснокислой среде:
NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O →
→ NaZn[(UO2)3(CH3COO)9]·9H2O↓ + HCl
Н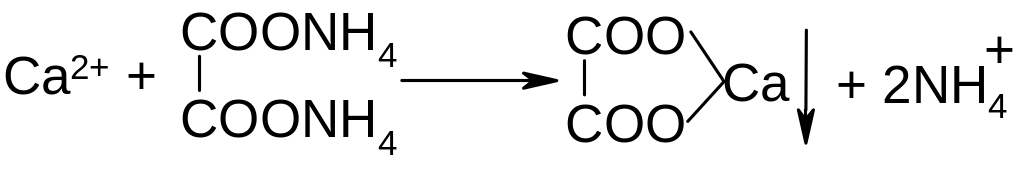 аличие
ионов кальция устанавливают по белому
осадку оксалата кальция при добавлении
к раствору оксалата аммония. Осадок
растворим в разведенных минеральных
кислотах.
аличие
ионов кальция устанавливают по белому
осадку оксалата кальция при добавлении
к раствору оксалата аммония. Осадок
растворим в разведенных минеральных
кислотах.
Реакцию проводят в присутствии уксусной кислоты.
2. Для количественного определения суммы хлоридов калия, натрия и кальция применяется метод аргентометрии (индикатор – хромат калия). Титруют до кирпично-красного окрашивания:
Cl- + AgNO3 → AgCl↓ + NO3-
K2CrO4 + AgNO3 → Ag2CrO4 + 2KNO3
кирпично-
красное
Кроме того, можно использовать меркуриметрическое титрование. В качестве титранта используют 0,1 М раствор нитрата ртути. Титрование проводят в присутствии азотной кислоты и индикатора дифенилкарбазида до синего окрашивания раствора:
2KCl + Hg(NO3)2 → HgCl2 + 2KNO3
2NaCl + Hg(NO3)2 → HgCl2 + 2NaNO3
CaCl2 + Hg(NO3)2 → HgCl2 + Ca(NO3)2

бесцветное синее
Натрия гидрокарбонат титруют раствором хлористоводородной кислоты до красного окрашивания индикатора метилового красного:
NaHCO3 + HCI → NaCI + CO2 + H2O
Содержание кальция хлорида определяют комплексонометрическим методом. Титруют раствором трилона Б в присутствии аммиачного буферного раствора (индикатор – хромовый темно-синий):
сине-фиолетовое окрашивание
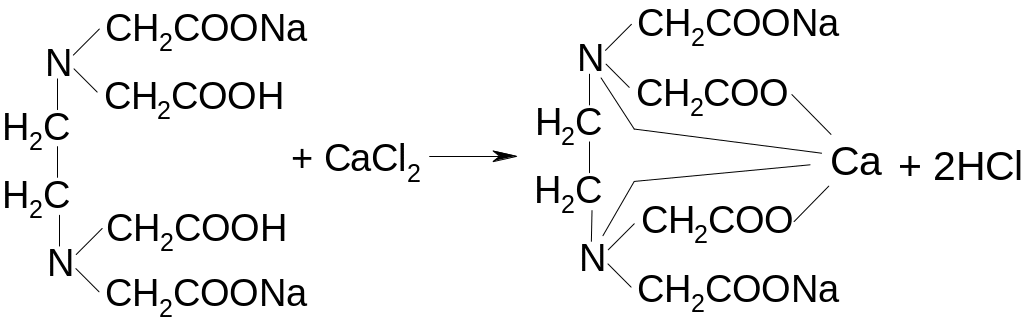
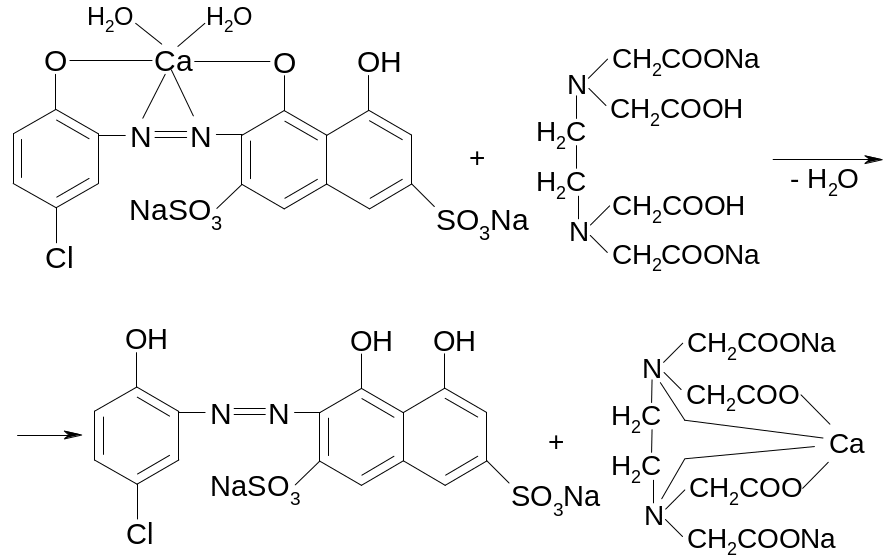
синее окрашивание
Расчет суммы хлоридов калия и натрия проводят после вычитания из объема нитрата серебра объема трилона Б, пошедшего на титрование кальция хлорида, по среднему ориентировочному титру:
![]() ,
,
где: Т1 – количество калия хлорида, соответствующее 1 мл 0,1 М раствора серебра нитрата, г;
Т2 – количество натрия хлорида, соответствующее 1 мл 0,1 М раствора серебра нитрата, г;
b1 – содержание калия хлорида по прописи;
b2 – содержание натрия хлорида по прописи.
Расчет количественного содержания суммы хлоридов калия и натрия в указанной лекарственной форме проводят по формуле:
![]() ,
,
где: V1 – объем титрованного раствора нитрата серебра или нитрата ртути;
V2 – объем титрованного раствора трилона Б;
К1 и К2 – поправочные коэффициенты к титрованным растворам;
Тср – среднй ориентировочный титр, г/мл;
Робщ – общая масса лекарственной формы, г;
а – масса навески лекарственной формы, взятая для титрования, г.
Т1 – количество калия хлорида, соответствующее 1 мл 0,1 М раствора серебра нитрата, г;
Т2 – количество натрия хлорида, соответствующее 1 мл 0,1 М раствора серебра нитрата, г;
