
- •Задача 1
- •Задача 2
- •Задача 3
- •Задача 4
- •Задача 5
- •Задача 6
- •Задача 7
- •Задача 8
- •Задача 9
- •Задача 10
- •Задача 11
- •Задача 12
- •Задача 13
- •Задача 14
- •Задача 15
- •Частные реакции на сульфацил-натрия:
- •Задача 16
- •Задача 17
- •Задача 18
- •Задача 20
- •Задача 21
- •Задача 22
- •Задача 23
- •Задача 24
- •Количественное определение
- •Задача 28
- •Задача 30
- •Задача 31
- •Задача 32
- •Задача 33
- •Задача 34
- •Задача 35
- •Задача 36
- •Задача 37
- •Задача 38
- •Задача 39
- •Задача 40
Задача 24
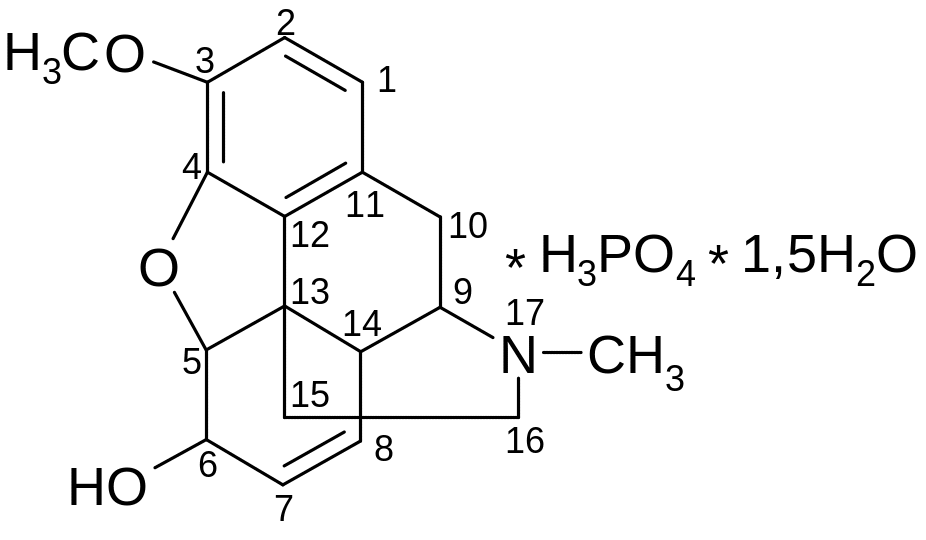
Кодеина фосфат
Codeini phosphas
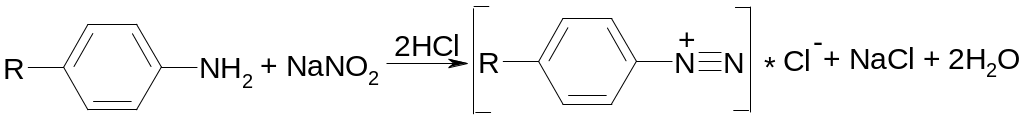
1. Фармакологическая группа. Кодеина фосфат относится к противокашлевым средствам центрального действия, т. е. непосредственно действует на противокашлевой центр продолговатого мозга. Кодеина фосфат является наркотическим веществом, вызывает привыкание и наркотическую зависимость.
По химическому строению кодеина фосфат относится к N-метилпроизводным морфинана (фенантренизохинолина):
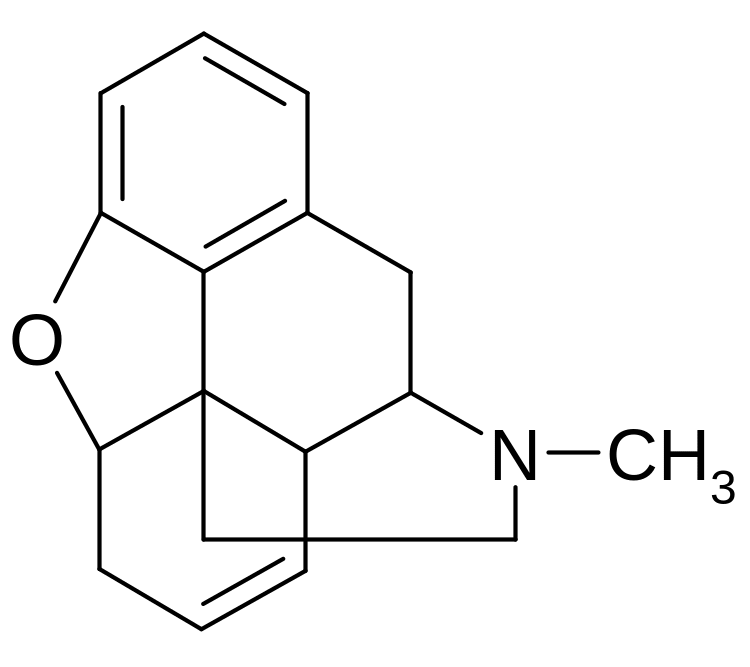
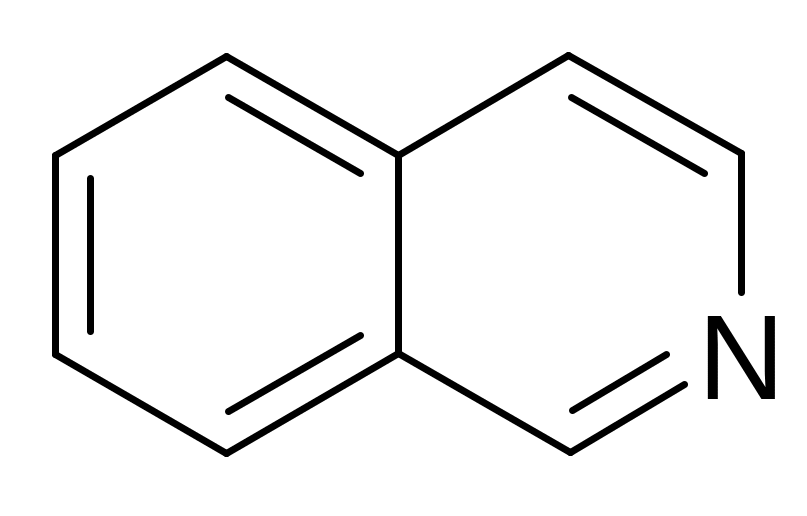
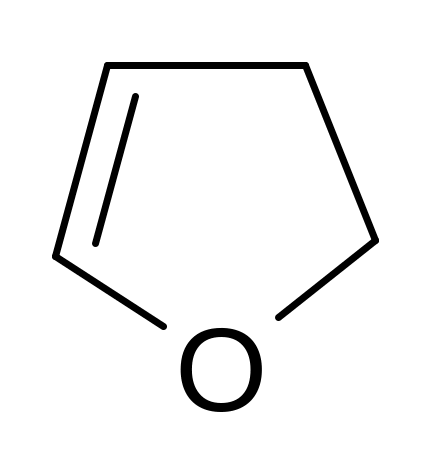
изохинолин дигидрофуран
N-метилморфинан
2. Большинство описанных цветных реакций идентификации кодеина фосфата основаны на его восстановительных свойствах, которые обусловлены наличием частично гидрированных циклов фенантренизохинолинового ядра.
Кодеин дает реакции:
с реактивом Марки – сине-фиолетовое окрашивание;
с реактивом Фреде – зеленое окрашивание.
Кодеина фосфат за счет третичной аминогруппы дает осадки с общеалкалоидными реактивами (Бушарда, Драгендорфа, Майера, и др.).
Фосфат-ион обнаруживают:
а) с раствором нитрата серебра – образуется желтый осадок:
H3PO4 + 3AgNO3 → Ag3PO4↓ + 3HNO3
б) с молибдатом аммония – образуется желтый осадок:
H3PO4 + 12(NH4)2MoO4 + 21HNO3 → (NH4)3PO4·12MoO3↓ + 21NH4NO3 + 12H2O
Для идентификации кодеина фосфата используют ИК-спектры в области 4000-400 см-1 (ФС) и УФ-спектры (растворитель – этанол, максимум при 284 нм).
Количественное определение
1) Метод неводного титрования (титрант - 0,1 М раствор хлорной кислоты) в среде безводной уксусной кислоты (ФС) [см. задачу № 21]. Индикатор – кристаллический фиолетовый.
2) Метод алкалиметрии (титрант – 0,1 М раствор гидроксида натрия в присутствии органического растворителя для растворения выделяющегося основания; индикатор – фенолфталеин):
R3N·H3PO4 + 2NaOH → R3N↓ + Na2HPO4 + 3H2O
3. Согласно ФС, кодеина фосфат в таблетках «Пенталгин» идентифицируют с помощью метода ТСХ на пластинках в присутствии свидетелей. Система растворителей: ацетон – толуол – диэтиламин (19,5 : 5 : 0,5). После высушивания пластинку проявляют в УФ-свете. Также используют метод ГЖХ. Кодеина фосфат идентифицируют по времени удерживания.
Количественное содержание кодеина фосфата в в данной лекарственной форме определяют методом ВЭЖХ. Расчет количества кодеина фосфата проводят по площадям пиков анализируемого и стандартного образцов.

Сульфокамфокаин
Sulfocamphocainum
1. Сульфокамфокаин представляет собой смесь сульфокамфорной кислоты и основания новокаина в соотношении 49,6 : 50,4.
В сухом виде смесь расплывается на воздухе, поэтому применяется в виде 10% водного раствора для инъекций.
Это прозрачная слегка желтоватая жидкость, рН 4,2-5,8.
В структуре сульфокамфокаина содержатся: сульфогруппа, кетогруппа, третичная аминогруппа, первичная ароматическая аминогруппа, сложноэфирная группа, ароматическое ядро.
2. Выбор реакций для подтверждения подлинности основывается на наличии перечисленных выше функциональных групп.
Сульфогруппу сульфокамфорной кислоты идентифицируют после минерализации с последующим воздействием концентрированной хлористоводородной кислотой. Образуется сульфат-ион, который обнаруживают с хлоридом бария:
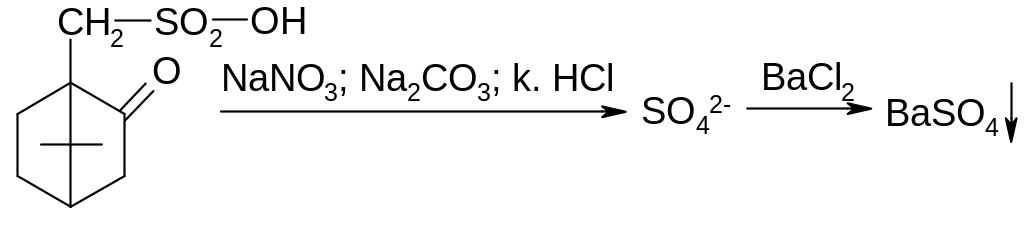
белый
Кетогруппа сульфокамфорной кислоты обнаруживается с помощью реакции взаимодействия с 2,4-динитрофенилгидразином. Образуется желтый осадок:
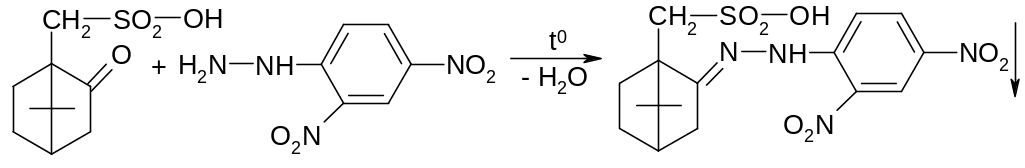
Новокаин обнаруживают с помощью реакций:
а) образования азокрасителя (на первичную ароматическую аминогруппу) [см. задачу № 9].
б) гидроксамовой пробы (на сложноэфирную группу). Возникает вишневое окрашивание:

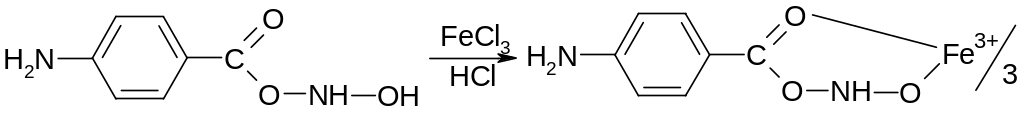
в) образование основания Шиффа с альдегидами в присутствии конц. хлористоводородной кислоты (оранжевое окрашивание):
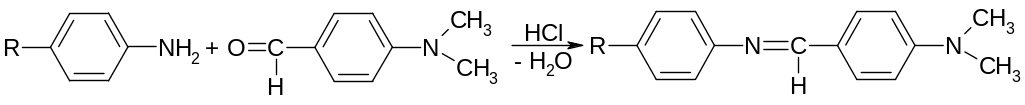
3. Количественное определение сульфокамфокаина проводят по основанию новокаина и кислоте сульфокамфорной.
Основание новокаина количественно определяют нитритометрическим методом. Титрант – 0,1 М раствор нитрита натрия, в присутствии хлористоводородной кислоты, катализатор – бромид калия, индикатор – нейтральный красный. Титруют медленно и на холоду:
Кислоту сульфокамфорную определяют алкалиметрически в присутствии хлороформа. Выделяющееся основание новокаина растворяется в хлороформе и не мешает определению кислоты сульфокамфорной.

Кроме того, известны методики фотоколориметрического определения сульфокамфокаина в растворе для инъекций. С этой целью используются либо реакции образования азокрасителя или гидроксамата железа (определение ведется по новокаину), либо реакция образования гидразона желтого цвета с 2,4-динитрофенилгидразином (определение ведется по аниону кислоты сульфокамфорной).
1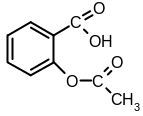 .
.
Кислота ацетилсалициловая
Acidum acetylsalicylicum
Салициловый эфир уксусной кислоты
Кислота ацетилсалициловая относится к ненаркотическим анальгетикам. Ацетилсалициловая кислота оказывает противовоспалительное, жаропонижающее и болеутоляющее действие. Применяют при лихорадочных состояниях, головной боли, невралгиях, в качестве противоревматического средства, выпускается в виде таблеток по 0,25 и 0,5 г.
2. По химической структуре кислота ацетилсалициловая относится к производным фенолокислот, является сложным эфиром салициловой и уксусной кислот. По физическим свойствам ацетилсалициловая кислота представляет собой бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом. Кислота ацетилсалициловая мало растворима в воде, но легко растворима в растворах гидроксидов щелочных металлов, этаноле, хлороформе. Поскольку в молекуле лекарственного вещества присутствуют ароматическое кольцо, кислота ацетилсалициловая обладает способностью поглощать электромагнитное излучение и для анализа может быть использован метод УФ-спектрофотометрии.
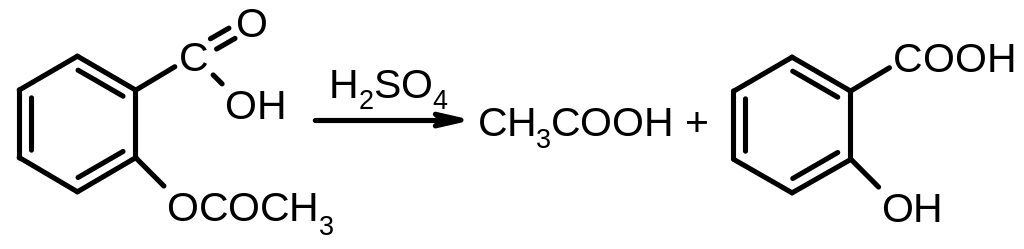
3. Для испытания подлинности кислоты ацетилсалициловой используют реакцию гидролиза сложно-эфирной группы в кислой или щелочной среде с последующей идентификацией продуктов гидролиза:
П ри
подкислении серной кислотой образуется
белый кристаллический осадок салициловой
кислоты и появляется запах уксусной
кислоты:
ри
подкислении серной кислотой образуется
белый кристаллический осадок салициловой
кислоты и появляется запах уксусной
кислоты:
белый
2CH3COONa + H2SO4 → 2CH3COOH + Na2SO4
Осадок отфильтровывают, а к фильтрату, содержащему уксусную кислоту, прибавляют этанол и концентрированную серную кислоту – образуется уксусно-этиловый эфир, обладающий характерным запахом фруктовой эссенции:
CH3COOH + HOC2H5 → CH3COOC2H5 + H2O
Салициловую кислоту, оставшуюся на фильтре, растворяют в этаноле и идентифицируют с помощью раствора хлорида железа (III) по образованию фиолетового окрашивания:
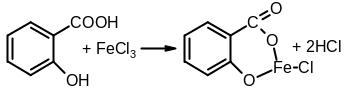
фиолетовый
При добавлении к раствору ацетилсалициловой кислоты концентрированной серной кислоты ощущается запах уксусной кислоты. При прибавлении к полученному раствору формалина появляется розовое окрашивание (ауриновый краситель):

ауриновый краситель
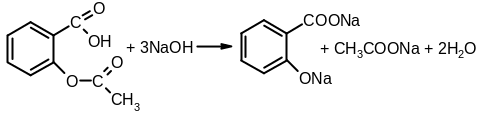
К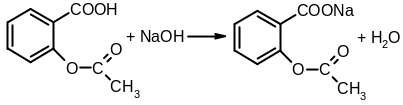 оличественное
определение ацетилсалициловой кислоты
проводят, используя метод нейтрализации
0,1 М раствором натрия гидроксида в
предварительно нейтрализованном по
фенолфталеину этаноле до розовой окраски
раствора:
оличественное
определение ацетилсалициловой кислоты
проводят, используя метод нейтрализации
0,1 М раствором натрия гидроксида в
предварительно нейтрализованном по
фенолфталеину этаноле до розовой окраски
раствора:
Кислоту ацетилсалициловую количественно можно определить также с использованием физико-химических методов (УФ-спектрофотометрия).
4. Промышленный способ получения кислоты аскорбиновой основан на синтезе из D-глюкозы, которую восстанавливают в D-сорбит каталитическим гидрированием. Важным этапом синтеза является процесс глубинного бактериохимического окисления (брожения) с помощью Acetobacter suboxydans D-сорбита до L-сорбозы:

D-глюкоза D-сорбит L-сорбоза
При количественном определении ацетилсалициловой кислоты необходимо учитывать влияние димедрола и аскорбиновой кислоты. Все три компонента определяются в сумме методом алкалиметрии. Затем определяют содержание димедрола методом аргентометрии и аскорбиновой кислоты методом иодиметрии. Содержание ацетилсалициловой кислоты вычисляют по разнице объемов натрия гидроксида, серебра нитрата и иода:
f = 1
f = 1
f = 1
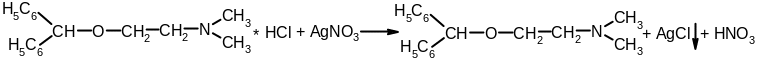
f = 1
f = 1/2
Если титрование проводится в навесках равной массы и титрованными растворами одинаковой концентрации, то содержание кислоты ацетилсалициловой (Х) рассчитывают по формуле:
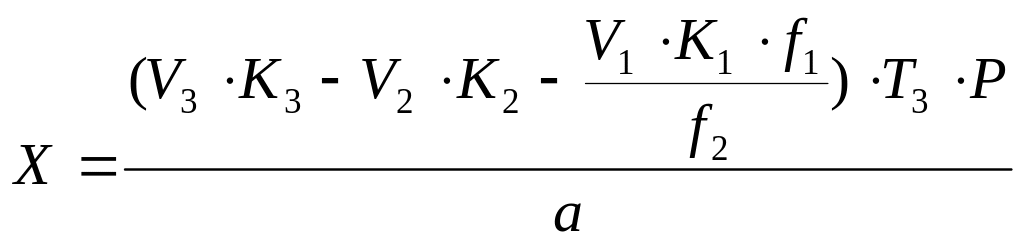 ,
,
где: V3 - объем 0,1 М раствора натрия гидроксида, мл;
V2 - объем 0,1 М раствора серебра нитрата, мл;
V1 - объем 0,1 М раствора иода, мл;
f1 – фактор аскорбиновой кислоты;
f2 – фактор ацетилсалициловой кислоты;
P - общая масса лекарственной формы, г.
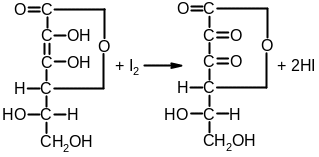
6. Кислоту ацетилсалициловую хранят в сухом месте в хорошо укупоренной таре. Во влажном воздухе постепенно гидролизуется с образованием уксусной и салициловой кислот. Салициловая кислота является специфической допустимой примесью. Содержание салициловой кислоты в ацетилсалициловой кислоте определяют методом фотоколориметрии по реакции с 0,2% раствором железоаммониевых квасцов.
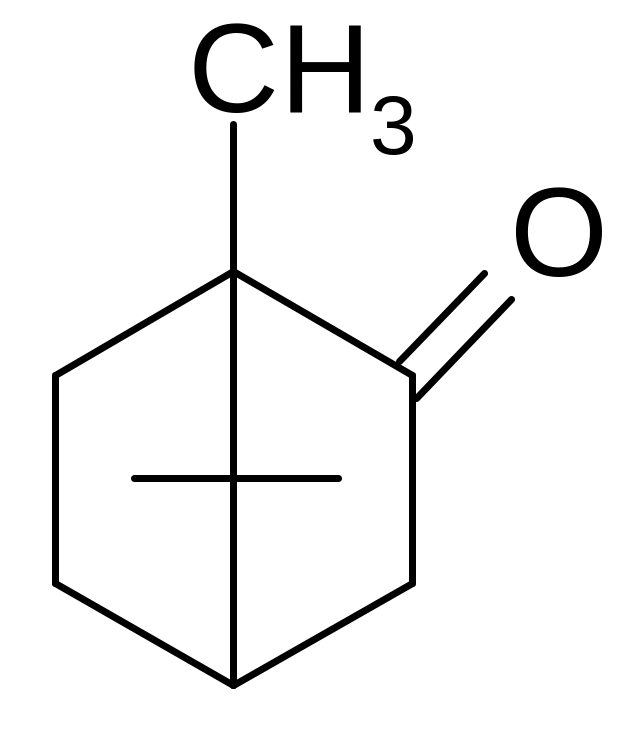
Камфора. Camphora
Камфора представляет собой белые кристаллические куски или бесцветный кристаллический порошок, или прессованные плитки с кристаллическим строением. Камфора обладает сильным характерным запахом. Практически нерастворима в воде, легко растворима в этаноле, очень легко в эфире, хлороформе, легко в жирных маслах. Камфора образует эвтектические смеси с ментолом, фенолом, тимолом, хлоралгидратом. Камфора образует сублимат, возгоняясь даже при комнатной температуре, флуоресцирует в УФ-свете.
2. По химической структуре камфора относится к бициклическим терпенам – производным углеводорода камфана. Ввиду наличия в молекуле камфоры двух асимметрических атомов углерода, существуют оптические изомеры d-, l- и рацемическая камфора. Температура плавления, затвердевания, кипения и значение удельного вращения служат константами, подтверждающими подлинность камфоры. Также для идентификации камфоры используют цветные реакции с фурфуролом или бензальдегидом:

фурфурол сине-фиолетовое
окрашивание
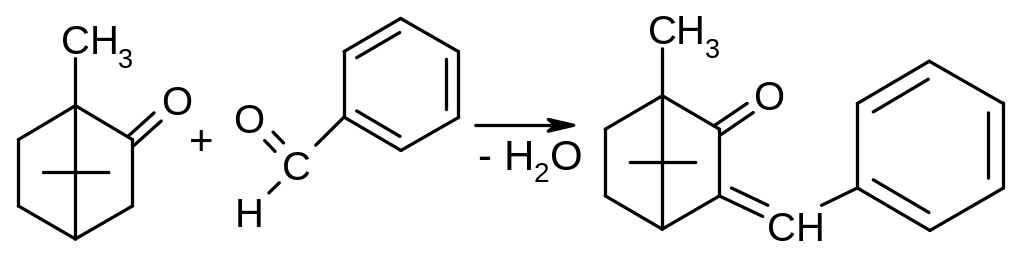
бензальдегид красное окрашивание
Наличие в молекуле камфоры кетогруппы обусловливает возможность проведения качественных реакций с образованием осадков или окрашенных продуктов:
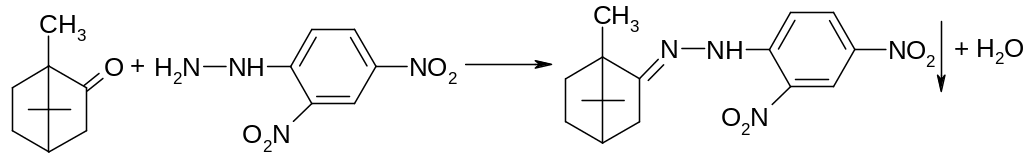
2,4-динитрофенилгидразон камфоры имеет определенную температуру плавления, являющуюся константой и используемую для подтверждения подлинности камфоры.
Для количественного определения камфоры используют оксимный способ, основанный на взаимодействии камфоры с определенным количеством гидроксиламина гидрохлорида:
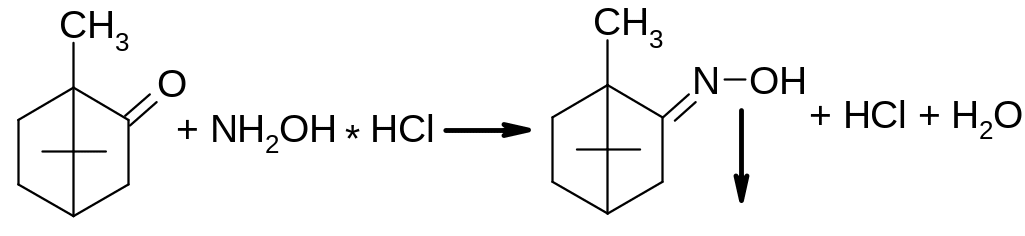
оксим
Нерастворимый в воде оксим определяют гравиметрическим методом или титруют выделившееся эквивалентное количество хлористоводородной кислоты:
HCl + NaOH → NaCl + H2O
Для испытания подлинности и количественного определения камфоры применяют также метод ГЖХ.
Хранят камфору в плотно укупоренных склянках оранжевого стекла в прохладном, защищенном от света месте, учитывая способность камфоры возгоняться.
