
- •Задача 1
- •Задача 2
- •Задача 3
- •Задача 4
- •Задача 5
- •Задача 6
- •Задача 7
- •Задача 8
- •Задача 9
- •Задача 10
- •Задача 11
- •Задача 12
- •Задача 13
- •Задача 14
- •Задача 15
- •Частные реакции на сульфацил-натрия:
- •Задача 16
- •Задача 17
- •Задача 18
- •Задача 20
- •Задача 21
- •Задача 22
- •Задача 23
- •Задача 24
- •Количественное определение
- •Задача 28
- •Задача 30
- •Задача 31
- •Задача 32
- •Задача 33
- •Задача 34
- •Задача 35
- •Задача 36
- •Задача 37
- •Задача 38
- •Задача 39
- •Задача 40
Задача 23


Глюкоза (МНН) Кислота аскорбиновая (МНН)
Glucosum Acidum ascorbinicum
Glucose γ-лактон 2,3-дигидро-
α-D-глюкопираноза L-гулоновой кислоты
1. Глюкоза. Глюкоза по фармакологическим свойствам относится к легко усвояемым питательным веществам, выделяющим большое количество энергии, необходимой для осуществления функций организма.
Кислота аскорбиновая. Относится к витаминным препаратам. Она участвует в окислительно-восстановительных процессах, образовании соединительной ткани, коллагена, кортикостероидов, обмене тирозина; является переносчиком водорода; активизирует ряд ферментов и т.д.
2. Глюкоза. По химическому строению глюкоза относится к гексозам. По пространственной конфигурации относится к производным D-глицеринового альдегида. Имеет несколько асимметрических атомов углерода, поэтому оптически активна.
Кислота аскорбиновая. По химическому строению вещество представляет собой γ-лактон-2,3-дегидро-L-гулоновой кислоты. Ввиду наличия двойной связи возможно существование цис- и транс- изомеров.
3. Глюкоза. По внешнему виду глюкоза представляет собой белый мелкокристаллический порошок без запаха, сладкого вкуса, легко растворим в воде, очень мало или умеренно в этаноле. Имеет кристаллизационную воду, которая при неправильном хранении выветривается.
Показателем
качества глюкозы является удельное
вращение в растворе (![]() = от + 52 до + 53º - 10% водный раствор). Измеряют
угол вращения на поляриметре. В раствор
добавляют 2 капли раствора аммиака для
ускорения процесса мутаротации.
= от + 52 до + 53º - 10% водный раствор). Измеряют
угол вращения на поляриметре. В раствор
добавляют 2 капли раствора аммиака для
ускорения процесса мутаротации.
Кислота аскорбиновая. Это белый кристаллический порошок без запаха, кислого вкуса, легко растворим в воде, медленно в этаноле.
Для идентификации определяют удельное вращение 2% водного раствора (от + 22 до + 24º).
4. Глюкоза. По химическому сроению глюкозу относят к альдегидам, поэтому она обладает окислительно-восстановительными свойствами. Окисляется до D-глюконовой кислоты, восстанавливается до сорбита.
Альдегидную группу глюкозы обнаруживают реакцией образования «серебряного зеркала». Реактив – аммиачный раствор нитрата серебра. Глюкоза также дает положительную реакцию с реактивом Фелинга [см. задачу № 14].
В данной прописи обнаружению глюкозы мешает аскорбиновая кислота, так как она также проявляет восстановительные свойства. Поэтому вначале проводят окисление аскорбиновой кислоты раствором иода, а затем проводят реакции на глюкозу.
Для количественного определения глюкозы используют как химические, так и физико-химические методы.
Основным титриметрическим методом является иодиметрия. Вначале проводят окисление глюкозы в щелочной среде, затем после подкисления непрореагировавший иод оттитровывают тиосульфатом натрия:
I2 + 2NaOH → NaIO + NaI + H2O
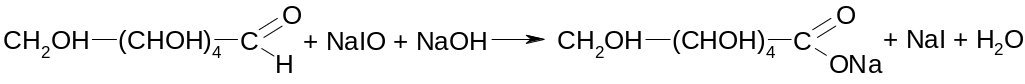
NaIO + H2SO4 + NaI → Na2SO4 + I2 + H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Из физико-химических методов используется поляриметрический метод. Зная удельное вращение ( ), длину кюветы (l, дм) и измерив угол вращения () можно вычислить концентрацию (%) глюкозы [см. задачу № 14].
Кислота аскорбиновая. По химическим свойствам кислота аскорбиновая является сильным восстановителем. В кристаллической форме устойчива, но в растворах в присутствии слабых окислителей быстро окисляется до дегидроаскорбиновой кислоты:
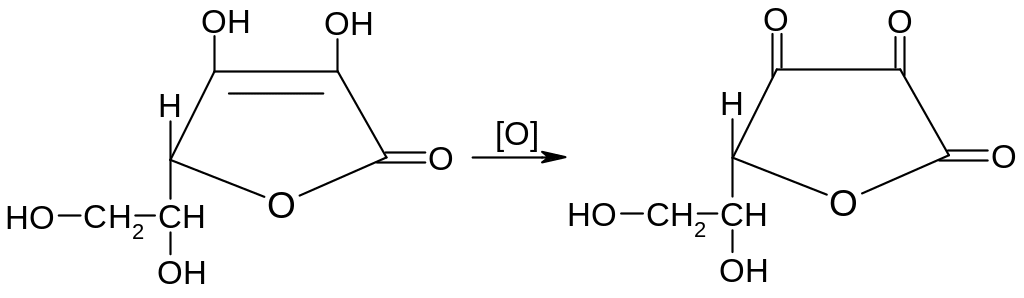
дегидроаскорбиновая кислота
В качестве окислителей используют: растворы нитрата серебра, хлорида железа (III), реактив Фелинга, гексацианоферрат (III) калия, раствор иода, перманганат калия и др.
Специфической реакцией является реакция ее окисления и обесцвечивание 2-6-дихлорфенолиндофенолята натрия:
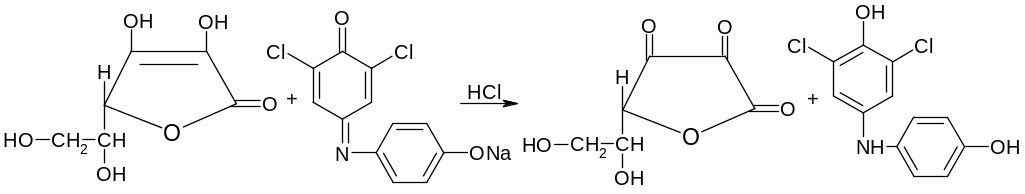
синий бесцветный
Кислотные свойства проявляет за счет наличия в молекуле двух енольных гидроксилов. Наиболее подвижным является водород в положении 3 (одноосновная кислота). С растворами щелочей образуются однозамещенные, бесцветные, растворимые в воде соли:

С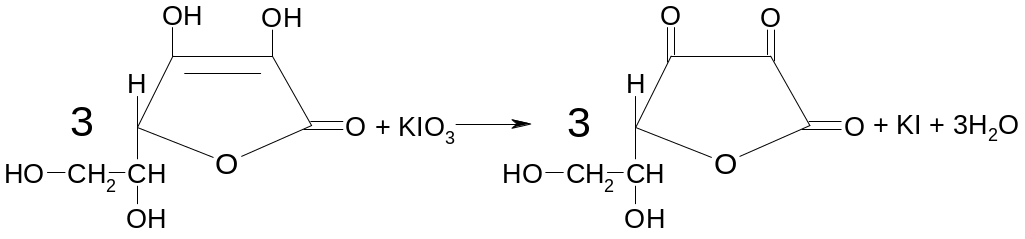 огласно
ФС кислоту аскорбиновую определяют
иодатометрически. Титрант – 0,1 моль/л
раствор иодата калия. Титрование проводят
в присутствие иодида калия:
огласно
ФС кислоту аскорбиновую определяют
иодатометрически. Титрант – 0,1 моль/л
раствор иодата калия. Титрование проводят
в присутствие иодида калия:
KIO3 + 5KI + 6HCl → 3I2 + 6KCl + 3H2O
Избыток иода окрашивает индикатор (крахмал) в синий цвет.
Кроме того, используются:
а) иодиметрический метод (титрант 0,1 М раствор I2 без индикатора, прямое титрование);
б) окислительно-восстановительное титрование (титрант – раствор 2,6-дихлорфенолиндофеналята натрия);
в) алкалиметрическое титрование 0,1 М раствором натрия гидроксида.
Широко используют фотоколориметрические способы, основанные на цветных реакциях с 2,6-дихлорфенолиндофенолом, фосфорномолибденовой кислотой.
Количественно глюкозу в присутствии кислоты аскорбиновой можно определить иодометрически после того, как оттитруют кислоту аскорбиновую 0,1 М раствором иода без идникатора. К оттитрованной жидкости добавляют гидроксид натрия и избыток титрованного раствора иода. Оставляют в темном месте на 10-15 минут, прибавляют разведенную серную кислоту. Выделившийся иод оттитровывают тиосульфатом натрия (индикатор крахмал).
5. Таблетки кислоты аскорбиновой с глюкозой хранят в сухом, темном месте, ввиду неустойчивости кислоты аскорбиновой на свету.
Для приготовления инъекционных растворов кислоты аскорбиновой обязательно добавляется стабилизатор (метабисульфит или гидросульфит натрия). Для стабилизации инъекционных растворов глюкозы добавляют 0,1 М раствор хлористоводородной кислоты, а для изотоничности – натрия хлорид. Стабилизаторы необходимы, так как при стерилизации глюкоза и кислота аскорбиновая окисляются.
