
- •Задача 1
- •Задача 2
- •Задача 3
- •Задача 4
- •Задача 5
- •Задача 6
- •Задача 7
- •Задача 8
- •Задача 9
- •Задача 10
- •Задача 11
- •Задача 12
- •Задача 13
- •Задача 14
- •Задача 15
- •Частные реакции на сульфацил-натрия:
- •Задача 16
- •Задача 17
- •Задача 18
- •Задача 20
- •Задача 21
- •Задача 22
- •Задача 23
- •Задача 24
- •Количественное определение
- •Задача 28
- •Задача 30
- •Задача 31
- •Задача 32
- •Задача 33
- •Задача 34
- •Задача 35
- •Задача 36
- •Задача 37
- •Задача 38
- •Задача 39
- •Задача 40
Задача 18
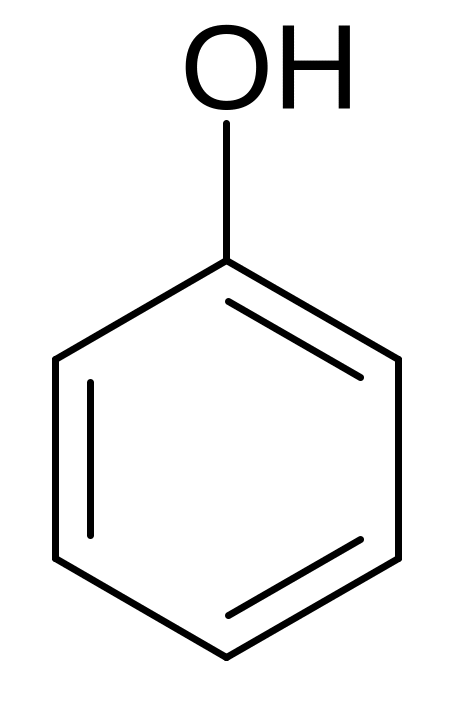
Фенол чистый. Phenolum purum. Оксибензол (МНН)
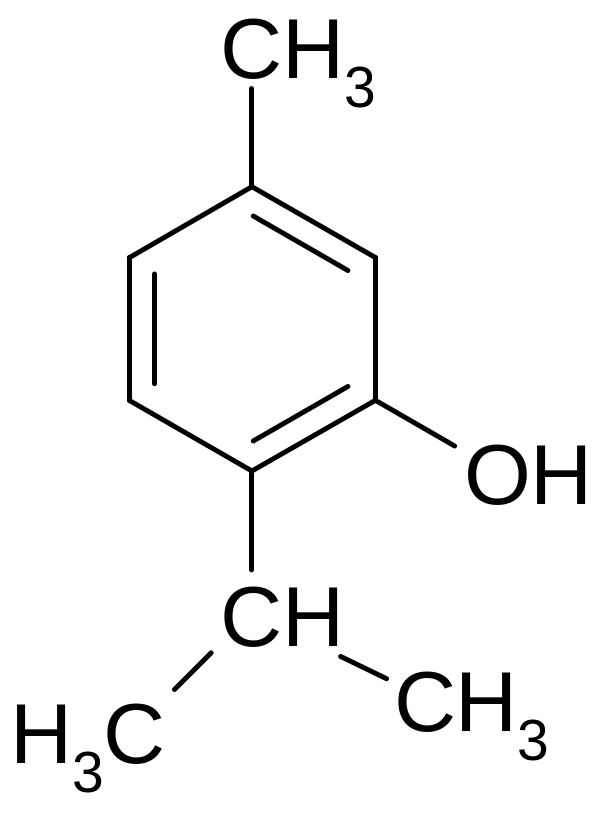
Тимол. Thymolum. 2-изопропил-5-метилфенол
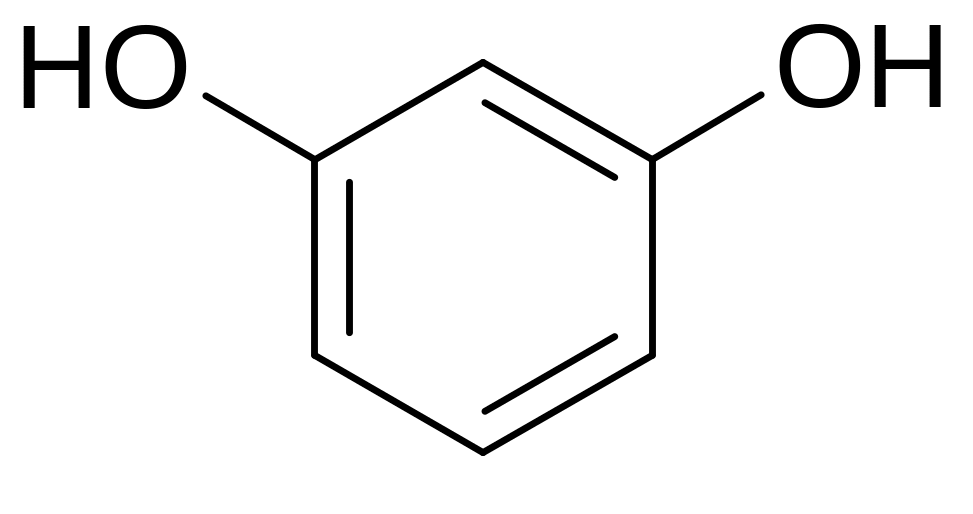
Резорцин. Resorcinum. м-диоксибензол
1. Химические свойства фенолов обусловлены как наличием в молекуле гидроксильной группы с подвижным атомом водорода, так и ароматического ядра. Фенолы проявляют слабые кислотные свойства.
Фенол, резорцин и тимол применяют в качестве антисептических средств. Раствор фенола применяют для дезинфекции. Резорцин назначают при кожных заболеваниях в виде 2-5% водных растворов, спиртовых растворов и 5-20% мазей. Тимол применяют внутрь в качестве антисептического средства при заболеваниях ЖКТ и как противоглистное средство.
2. Фенол, резорцин и тимол по физическим свойствам – бесцветные или белые кристаллические вещества.
Под влиянием света и кислорода воздуха фенол и резорцин легко окисляются и приобретают розовое окрашивание.
Фенолы имеют характерный запах. Лекарственные вещества отличаются друг от друга по температуре плавления. Одним из свойств тимола является его способность в холодной воде погружаться, а при повышении температуры до 45ºС плавиться и подниматься на поверхность.
Тимол при растирании с камфорой, ментолом, хлоралгидратом образует эвтектические смеси.
Фенол и резорцин хорошо растворимы в воде, а тимол очень мало растворим.
Б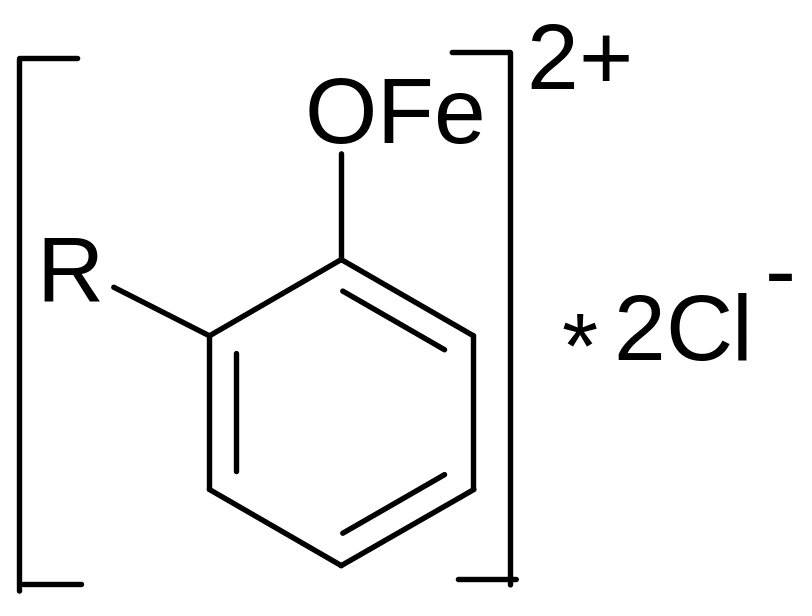 ольшинство
фенолов образует с хлоридом железа
(III)
окрашенные соединения. Окраска зависит
от числа и расположения в молекуле
фенольных гидроксилов
ольшинство
фенолов образует с хлоридом железа
(III)
окрашенные соединения. Окраска зависит
от числа и расположения в молекуле
фенольных гидроксилов
При сочетании фенолов с солями диазония в щелочной среде происходит реакция образования окрашенных оксиазосоединений:
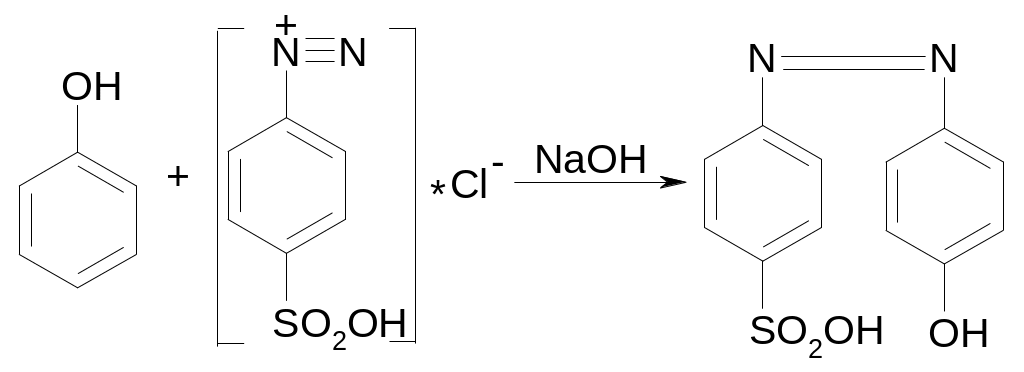
фенол соль диазония оксиазосоединение
красное окрашивание
Реакция Либермана основана на взаимодействии фенолов с нитрозосоединениями. При добавлении концентрированной серной кислоты смесь окрашивается в вишнево-красный цвет, который после добавления избытка гидроксида натрия переходит в темно-синий.
П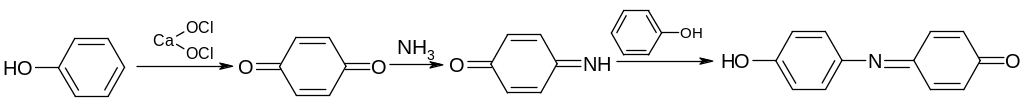 ри
окислении гипохлоритом натрия или
бромной водой в присутствии аммиака
образуется индофенол:
ри
окислении гипохлоритом натрия или
бромной водой в присутствии аммиака
образуется индофенол:
хинон хинонимин индофенол
Фенол образует зеленое окрашивание, тимол и резорцин – синее окрашивание.
Для фенолов характерна реакция замещения. Так, с бромной водой образуются осадки ди- и трибромпроизводных:
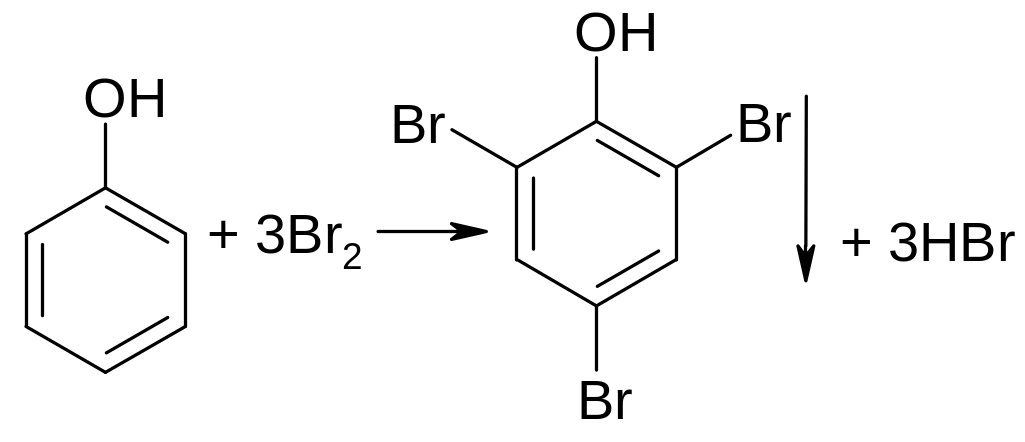
фенол
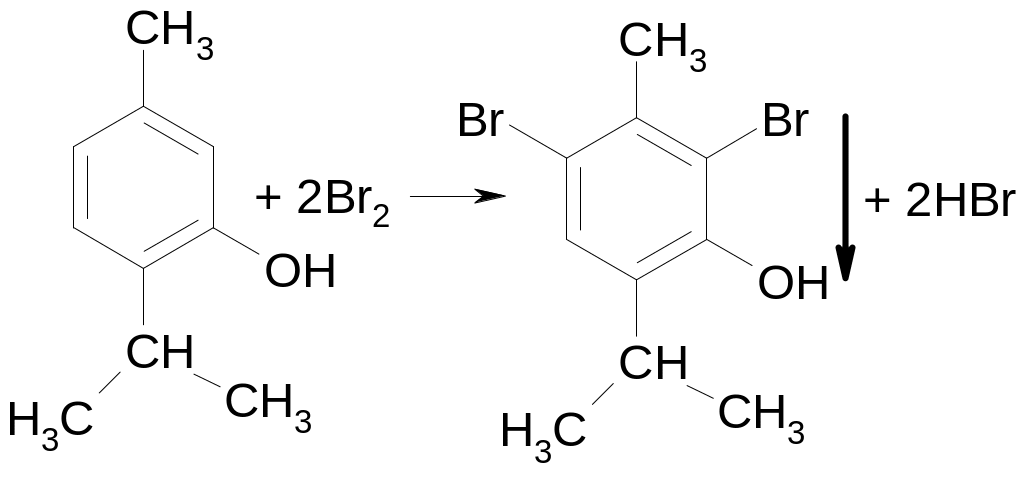
тимол
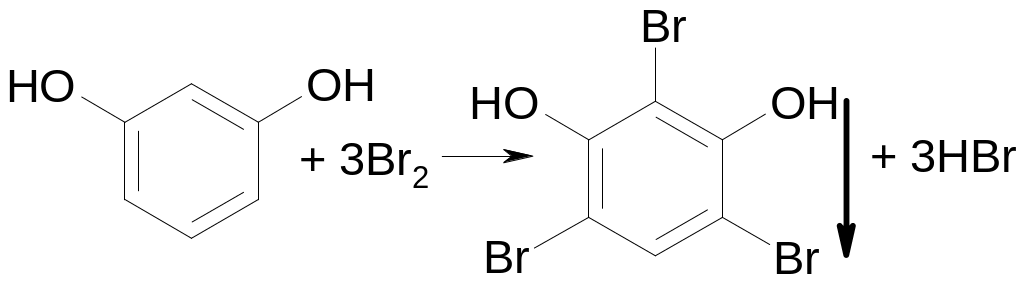
резорцин
О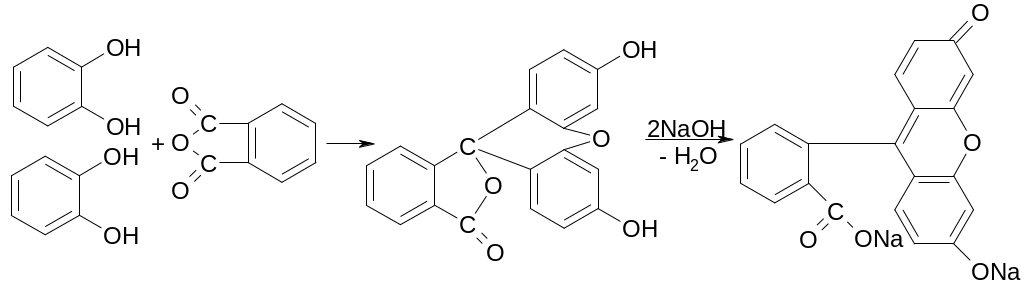 тличительной
реакцией на резорцин является реакция
конденсации с фталиевым ангидридом с
образованием флуоресцеина:
тличительной
реакцией на резорцин является реакция
конденсации с фталиевым ангидридом с
образованием флуоресцеина:
3. Количественное определение фенолов в субстанции и лекартвенных формах проводят методом броматометрии (прямой и обратный варианты). В качестве титрованного раствора используют 0,1 М раствор бромата калия. Определение ведут в присутствии бромида калия в кислой среде. Выделяющийся бром вступает в реакцию с фенолом.
KBrO3 + 5KBr + 3H2SO4 → 3Br2 + 3K2SO4 + 3H2O
[реакцию галогенирования фенола см. раздел 2]
В случае прямого титрования используют индикатор метиловый красный, который обесцвечивается в конце титрования.
В случае обратного титрования избыток бромата калия определяют йодометрически [см. задачу № 1].
Титр по определяемому веществу рассчитывают по формуле:
![]() .
(1) [см. задачу № 8]
.
(1) [см. задачу № 8]
Количественное содержание лекарственного вещества рассчитывают по формуле:
а) в случае прямого титрования:
, (2)
где: V – объем титранта, мл;
К – поправочный коэффициент титранта;
Т – титр титранта по определяемому веществу, г/мл;
а – масса навески, г.
б) в случае обратного титрования:
![]() ,
,
где: V к.о. – объем титранта, израсходованный в контрольном опыте, мл.
При анализе лекарственной формы:
в) в случае прямого титрования:
![]()
г) в случае обратного титрования:
![]() ,
,
где: Р – общее количество лекарственной формы.
4. Так как фенолы легко окисляются, то их хранят в хорошо укупоренной таре, предохраняющей от действия света и воздуха. Лекарственные препараты фенолов хранят по списку Б, в прохладном месте (тимол – при температуре не выше 25ºС, так как это лекарственное вещество легко возгоняется).
При несоблюдении условий хранения, в присутствии кислорода воздуха, лекарственные вещества этой группы постепенно окисляются, приобретая розовое окрашивание. Поэтому нормативная документация допускает изменение цвета до розового.
Задача 19
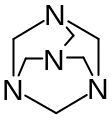
(CH2)6N4
Гексаметилентетрамин. Hexamethylentetraminum
Метенамин (МНН)
1. Гексаметилентетрамин применяется как антисептическое средство внутрь в таблетках по 0,5-1,0 г и внутривенно в виде 40% раствора по 5-10 мл.
По химическому строению гексаметилентетрамин может быть отнесен к гетероциклическим соединениям производным 1,3,5-триазина.
Лекарственное вещество представляет собой бесцветные кристаллы или белый кристаллический порошок без запаха, жгучего и сладкого, а затем горьковатого вкуса.
2![]() .
Реакция гидролиза в кислой среде
рекомендуется для испытания на подлинность
этого лекарственного вещества:
.
Реакция гидролиза в кислой среде
рекомендуется для испытания на подлинность
этого лекарственного вещества:
Выделяющийся при нагревании препарата с разведенной серной кислотой формальдегид определют по запаху и по реакции с салициловой кислотой (образуется ауриновый краситель):
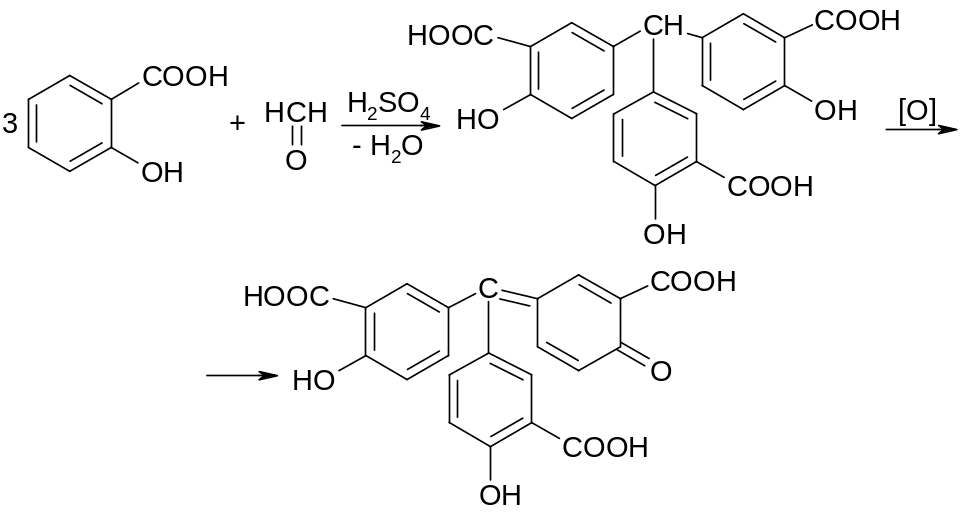
красное окрашивание
После гидролиза можно добавить раствор щелочи, появляется запах аммиака:
(NH4)2SO4 + 2NaOH → 2NH3↑ + Na2SO4 + 2H2O
Так как гексаметилентетрамин содержит третичные аминогруппы, то он осаждается из растворов пикриновой кислотой (желтый осадок), раствором иода в растворе иодида калия (красно-бурый осадок), бромной водой (оранжево-желтый осадок).
Количественное определение гексаметилентетрамина проводят путем гидролиза в присутствии титрованного раствора кислоты серной (см. реакцию). Избыток серной кислоты оттитровывают щелочью:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Гексаметилентетрамин в водных растворах проявляет свойства однокислотного основания. Поэтому количественное определение можно выполнить методом нейтрализации без гидролиза этого лекарственного вещества, используя в качестве индикатора смесь метилового оранжевого и метиленового синего:
(CH2)6N4 + HCl → (CH2)6N4·HCl
3. Гексаметилентетрамин хранят в хорошо укупоренной таре при температуре не выше 20ºС, учитывая его способность возгоняться. Во влажной среде он может подвергаться гидролизу с образованием формальдегида и аммиака:
![]()
