
- •Задача 1
- •Задача 2
- •Задача 3
- •Задача 4
- •Задача 5
- •Задача 6
- •Задача 7
- •Задача 8
- •Задача 9
- •Задача 10
- •Задача 11
- •Задача 12
- •Задача 13
- •Задача 14
- •Задача 15
- •Частные реакции на сульфацил-натрия:
- •Задача 16
- •Задача 17
- •Задача 18
- •Задача 20
- •Задача 21
- •Задача 22
- •Задача 23
- •Задача 24
- •Количественное определение
- •Задача 28
- •Задача 30
- •Задача 31
- •Задача 32
- •Задача 33
- •Задача 34
- •Задача 35
- •Задача 36
- •Задача 37
- •Задача 38
- •Задача 39
- •Задача 40
Частные реакции на сульфацил-натрия:
Сульфацил-натрий при действии уксусной кислотой выделяет белый осадок сульфацила, который после высушивания должен иметь температуру плавления около 183ºС:

При растворении осадка в этаноле и добавлении концентрированной серной кислоты образуется этилацетат, имеющий характерный запах:

Катион натрия можно обнаружить по окраске бесцветного пламени в желтый цвет.
Количественное определение сульфацила-натрия можно провести с помощью физико-химических методов анализа.
Используют УФ-спектроскопию, фотоколориметрию.
УФ-спектр сульфацила-натрия имеет максимум светопоглощения при 256 нм. Содержание рассчитывают по раствору стандартного образца.
Фотоколориметрический метод основан на измерении оптической плотности окрашенных продуктов реакции (реакции образования азокрасителя).
Широко используют для количественного определения сульфацила-натрия нитритометрию. Титрант – 0,1 М раствор нитрита натрия. Определение ведут в кислой среде при температуре + 4ºС в присутствии бромида калия. Точку эквивалентности устанавливают по внутреннему индикатору – нейтральному красному, по внешнему индикатору – иодкрахмальной бумаге [см. задачу № 9].
Натриевые соли сульфаниламидных препаратов титруют кислотой в спирто-ацетоновой среде (индикатор – метиловый оранжевый):

Метод броматометрического определения основан на галогенировании сульфаниламидов. Титруют раствором бромата калия в кислой среде в присутствии калия бромида. Конец титрования устанавливают по обесцвечиванию индикатора метилового оранжевого выделяющимся бромом, или иодометрически [см. задачу № 1].
3. Сульфацил-натрий как кристаллогидрат при неправильном хранении постепенно теряет воду. Сульфацил-натрий может поглощать углекислый газ, при этом его растворимость уменьшается. При длительном хранении растворы могут желтеть, так как происходит постепенное окисление сульфацила-натрия.
Задача 16

Висмута нитрат основной
Bismuthi subnitras
1. Относится к вяжущим, антисептическим средствам. Применяется при желудочно-кишечных заболеваниях.
Практически нерастворим в воде и этаноле. Однако, смоченный водой, он окрашивает синюю лакмусовую бумагу в красный цвет вследствие гидролиза с образованием азотной кислоты и гидроксида висмутила:

Висмута нитрат основной растворим в кислотах (азотной, соляной):
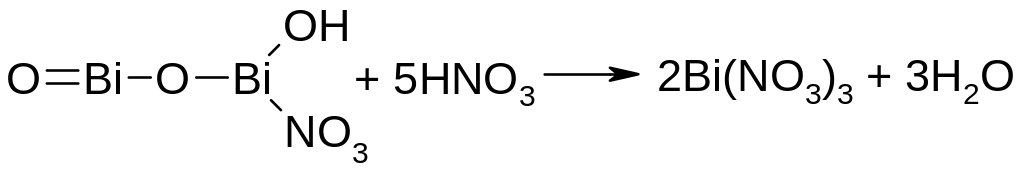
Эти реакции можно использовать в контроле качества лекарственной формы.
MgO
Магния окись
Магния оксид. Magnesii oxydum
Относится к антацидным средствам. Магния оксид применяют при повышенной кислотности желудочного сока.
Магния оксид практически нерастворим в воде и в этаноле, но растворим в разведенных кислотах:
MgO + 2HCl → MgCl2 + H2O
2. Для установления подлинности висмута нитрата основного можно использовать реакцию с сульфидом натрия после растворения лекарственной формы в азотной кислоте:
2Bi(NO3)3 + 3Na2S → Bi2S3↓ + 6NaNO3
коричнево-
черный осадок
После взбалтывания лекарственной формы с разведенной серной кислотой и отфильтровывания осадка к фильтрату добавляют две капли раствора иодида калия. Образуется черный осадок иодида висмута, растворимый в избытке реактива:
Bi2(SO4)3 + 6KI → 2BiI3↓ + 3K2SO4
BiI3 + KI → KBiI4
желто-оранжевое
окрашивание
Для установления подлинности магния оксида лекарственную форму растворяют в хлористоводородной кислоте. Затем добавляют раствор гидрофосфата натрия и раствор аммиака. Образуется белый осадок:
M![]() gCl2
+ Na2HPO4
+ NH4OH
NH4MgPO4↓
+ 2NaCl
+ H2O
gCl2
+ Na2HPO4
+ NH4OH
NH4MgPO4↓
+ 2NaCl
+ H2O
белый
3. Количественное определение висмута нитрата основного в лекарственной форме выполняют комплексонометрическим методом.
Навеску лекарственной формы растворяют при нагревании в азотной кислоте и титруют 0,05 М раствором трилона Б в присутствии индикатора пирокатехинового фиолетового:

пирокатехиновый окраска синяя
фиолетовый
окраска желтая

В![]() точке эквивалентности выделяется
свободный индикатор:
точке эквивалентности выделяется
свободный индикатор:
окраска синяя окраска желтая
Содержание висмута нитрата основного рассчитывают по формуле:
![]() ,
(1)
,
(1)
где: V – объем титранта, мл;
K –коэффициент поправки титранта;
Т – титр титранта по определяемому веществу, г/мл;
Р – общее количество лекарственной формы по прописи, г;
а – навеска, взятая для анализа, г.
Особенность анализа заключается в том, что в висмута нитрате основном должно быть 79-82% висмута оксида, поэтому расчет проводят по условному титру. Условный титр висмута нитрата основного рассчитывают по формуле:
![]() ,
,
где: Т – титр-соответствие трилона Б по висмута окиду, г/мл;
ω –средний предел содержания висмута нитрата основного, %.
Известно, что в данных условиях (кислая среда, индикатор пирокатехиновый фиолетовый) магния оксид не мешает титрованию висмута нитрата основного.
Магния оксид можно определить в лекарственной форме комплексонометрическим методом с использованием индикатора кислотного хром черного специального.
MgO + 2HNO3 → Mg(NO3)2 + H2O
[реакции – см. задачу № 2]
Содержание магния оксида рассчитывают по формуле (1).
