
- •Задача 1
- •Задача 2
- •Задача 3
- •Задача 4
- •Задача 5
- •Задача 6
- •Задача 7
- •Задача 8
- •Задача 9
- •Задача 10
- •Задача 11
- •Задача 12
- •Задача 13
- •Задача 14
- •Задача 15
- •Частные реакции на сульфацил-натрия:
- •Задача 16
- •Задача 17
- •Задача 18
- •Задача 20
- •Задача 21
- •Задача 22
- •Задача 23
- •Задача 24
- •Количественное определение
- •Задача 28
- •Задача 30
- •Задача 31
- •Задача 32
- •Задача 33
- •Задача 34
- •Задача 35
- •Задача 36
- •Задача 37
- •Задача 38
- •Задача 39
- •Задача 40
Задача 14
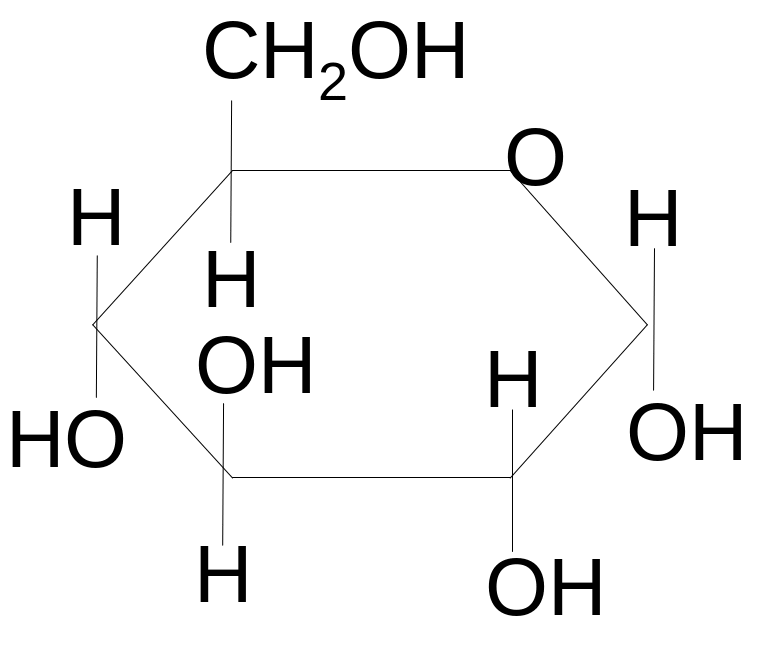
1.
Глюкоза
Glucosum
α-D-глюкопираноза
Фармакологическая группа – сахара.
Применяется при гипогликемии, интоксикациях, поражении паренхиматозных органов.
Применяют глюкозу при различных заболеваниях сердца, печени, при шоке в качестве источника легко усваиваемого организмом питания.
3. Глюкозу относят к углеводам. Это полиоксикарбонильные соединения: полиоксиальдегиды или полиоксикетоны. Глюкоза – полиоксиальдегид.
Белый кристаллический порошок без запаха, сладкого вкуса. Легко растворим в воде, очень мало или трудно – в этаноле, практически нерастворим в эфире и хлороформе. Наличие асимметрических атомов углерода обусловливает оптическую активность глюкозы. Характерной константой для глюкозы является удельное вращение.
4. Восстановительные свойства глюкозы используют для качественного и количественного анализа глюкозы.
Подлинность глюкозы устанавливают по реакции с реактивом Фелинга. При этом образуется кирпично-красный осадок оксида меди (I):
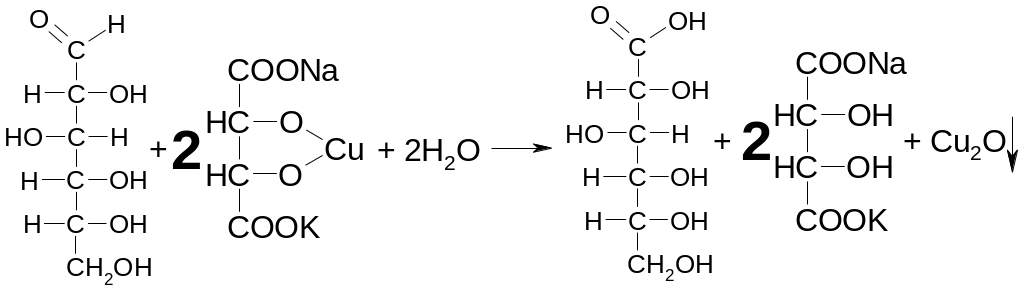
П ри
нагревании с аммиачным раствором нитрата
серебра происходит выделение серебра
– «серебряное зеркало»:
ри
нагревании с аммиачным раствором нитрата
серебра происходит выделение серебра
– «серебряное зеркало»:
Количественное содержание глюкозы определяют иодометрическим методом, основанном на окислении альдегидной группы иодом в щелочной среде:
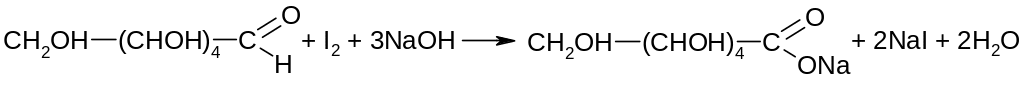
Широко используют физико-химические методы анализа: поляриметрию и рефрактометрию.
Поляриметрический
метод основан на измерении угла вращения
плоскости поляризации поляризованного
света. Угол вращения α (в градусах),
измеряемый на поляриметре, и удельное
вращение
![]() связаны между собой уравнением:
связаны между собой уравнением:
![]() .
.
Зная удельное вращение, длину трубки l и измерив угол вращения, можно вычислить концентрацию глюкозы (%) по формуле:
![]() .
.
Метод рефрактометрии основан на зависимости величины показателя преломления света от концентрации раствора испытуемого вещества. Для количественного определения выбирают интервал линейной зависимости между концентрацией раствора и показателем преломления. Концентрацию вычисляют по формуле:
![]() ,
,
где: n – показатель преломления раствора вещества;
n0 – показатель преломления растворителя;
F – фактор, равный величине прироста показателя преломления при увеличении концентрации вещества на 1%.
Рефрактометрическое определение выполняют на рефрактометрах при стабильной температуре (20 ± 3ºС) и длине волны линии D спектра натрия (589,3 нм) в диапазоне показателей преломления от 1,3 до 1,7. Прибор юстируют по эталонным жидкостям или воде очищенной, для которой n0 = 1,3330.
Особое внимание уделяется испытаниям на чистоту глюкозы. Под действием внешних факторов, особенно повышенной температуры, она подвергается различным химическим превращениям.
Например, при стерилизации растворов образуются токсичные для организма человека соединения, что нужно учитывать при выборе состава и режима стерилизации растворов глюкозы.
Задача 15
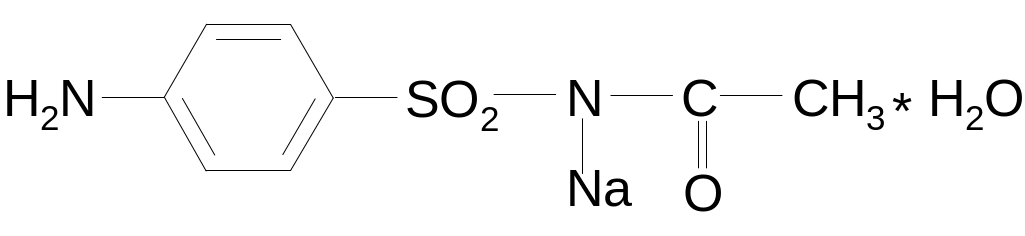
1.
Сульфацил-натрий
Sulfacilum natrium
Сульфацетамид натрия (МНН)
n-аминобензолсульфонилацетамид-натрий моногидрат
Относится к группе производных n-аминобензолсульфамида (сульфаниламидов).
Фармакологическое действие сульфаниламидов обусловлено наличием в молекуле лекарственного вещества амида сульфаниловой кислоты. Сульфацил-натрий обладает, как и все сульфаниламиды, химиотерапевтической активностью при инфекциях, вызванных грамположительными и грамотрицательными бактериями.
Хорошая растворимость в воде позволяет использовать сульфацил-натрий для инъекций при пневмониях, гнойных трахеобронхитах, инфекциях мочеполовых путей. Назначают в глазной практике в виде 20-30% растворов и мазей.
Сульфацил-натрий – белый кристаллический порошок без запаха. Как и другие натриевые соли, легко растворим в воде и метаноле и практически нерастворим в органических растворителях (этаноле, эфире, хлороформе, ацетоне).
Сульфацил-натрий можно идентифицировать по характеру УФ-спектров.
2. Для идентификации используют общие и частные реакции, обусловленные физико-химическими свойствами, растворимостью и наличием функциональных групп в молекуле: первичной ароматической аминогруппы, ароматического цикла, сульфамидной группы, ацетильной группы.
Общие реакции:
Реакция образования азокрасителя (на первичную ароматическую аминогруппу) основана на образовании хлорида диазония при действии раствором нитрита натрия и разведенной хлороводородной кислотой. Последующее сочетание хлорида диазония с фенолами в щелочной среде приводит к образованию азокрасителя [см. задачу № 1].
Лигниновая проба. Это своеобразная разновидность реакции образования шиффовых оснований. Она выполняется на древесине или газетной бумаге, при нанесении на которую сульфацила-натрия и капли разведенной соляной кислоты появляется оранжево-желтое окрашивание [см. задачу № 1].
Реакция галогенирования (на ароматический цикл) [см. задачу № 1].
Реакция обнаружения серы (в сульфамидной группе). Наличие серы в молекуле сульфацила-натрия можно установить по реакции на сульфат-ион после нагревания препарата с азотной кислотой.
При термическом разложении сульфацила-натрия в сухой пробирке образуется окрашенный плав и ощущается запах уксусной кислоты.
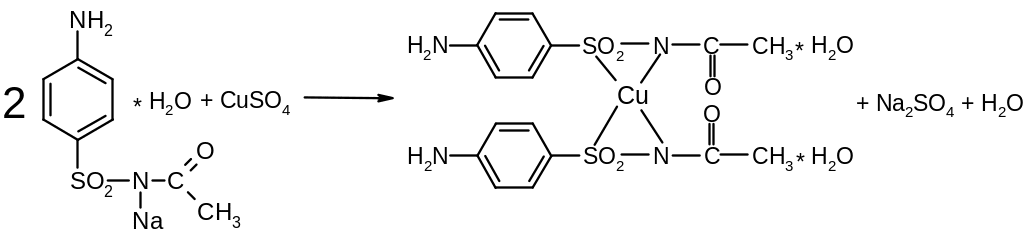
Реакция с растворами солей тяжелых металлов. Ионы меди, замещая подвижный атом водорода сульфамидной группы, образуют с сульфацилом-натрия внутрикомплексное соединение голубовато-зеленоватого цвета:
Реакция с нитропруссидом натрия. Раствор сульфацила-натрия в присутствии едкой щелочи образует окрашеный в красный цвет раствор.
