
- •Задача 1
- •Задача 2
- •Задача 3
- •Задача 4
- •Задача 5
- •Задача 6
- •Задача 7
- •Задача 8
- •Задача 9
- •Задача 10
- •Задача 11
- •Задача 12
- •Задача 13
- •Задача 14
- •Задача 15
- •Частные реакции на сульфацил-натрия:
- •Задача 16
- •Задача 17
- •Задача 18
- •Задача 20
- •Задача 21
- •Задача 22
- •Задача 23
- •Задача 24
- •Количественное определение
- •Задача 28
- •Задача 30
- •Задача 31
- •Задача 32
- •Задача 33
- •Задача 34
- •Задача 35
- •Задача 36
- •Задача 37
- •Задача 38
- •Задача 39
- •Задача 40
Задача 12
Na2S2O3·5H2O
Натрия тиосульфат
Natrii thiosulfas
1. Фармакологическая группа – специфические антидоты (сорбенты, комплексоны).
Фармакологическое действие натрия тиосульфата обусловлено наличием серы в тиогруппе. Он оказывает противотоксическое, противовоспалительное и десенсибилизирующее действие. Как противотоксическое средство применяют при отравлении соединениями мышьяка, ртути, свинца. Назначают также внутривенно, внутрь при аллергических заболеваниях, артритах, невралгиях в виде 10% и 30% растворов.
Наружно натрия тиосульфат применяют для лечения больных чесоткой по методу Демьяновича, основанному на способности тиосульфата распадаться в кислой среде с выделением серы и оксида серы (IV), оказывающих противопаразитарное действие.
2. Натрия тиосульфат – это бесцветные прозрачные кристаллы без запаха. Он очень легко растворим в воде, практически нерастворим в этаноле. Проявляет восстановительные свойства. Сильные окислители окисляют его до сульфата натрия, слабые – до тетратионата натрия.
Это неорганическое соединение, поэтому качественный анализ сводится к определению катиона натрия и тиосульфат-иона.
Ион натрия окрашивает бесцветное пламя горелки в желтый цвет.
Кроме того, ионы натрия осаждают цинкуранилацетатом (см. задачу № 10).
Тиосульфат-ион обнаруживают по обесцвечиванию раствора иода (реакция – см. количетвенное определение), по образованию опалесценции (за счет выделения серы) и появлению запаха (диоксида серы) при добавлении соляной кислоты:
Na2S2O3 + 2HCl → SO2↑ + S↓ + 2NaCl + H2O
С избытком раствора нитрата серебра образуется белый осадок тиосульфата серебра, который быстро разлагается. Осадок желтеет, затем буреет и, наконец, становится черным (образуется сульфид серебра):
Na2S2O3 + 2AgNO3 → Ag2S2O3↓ + 2NaNO3
Ag2S2O3 → Ag2SO3 + S↓
Ag2SO3 + S + H2O → Ag2S↓ + H2SO4
Для количественного определения используют окислительно-восстановительную реакцию с иодом. Титрант – 0,1 М раствор иода. Определение можно вести без индикатора до появления устойчивой желтой окраски:
2Na2S2O3 + I2 → 2NaI + Na2S4O6
При качественном и количественном определении натрия тиосульфата в предложенной лекарственной форме следует учитывать присутствие калия иодида. Поэтому для качественного анализа натрия тиосульфата целесообразнее использовать реакцию взаимодействия с хлороводородной кислотой.
При количественном определении в лекарственной форме предварительно натрия тиосульфат извлекают водой из лекарственной формы, а затем титруют 0,1 М раствором иода.
Задача 13
1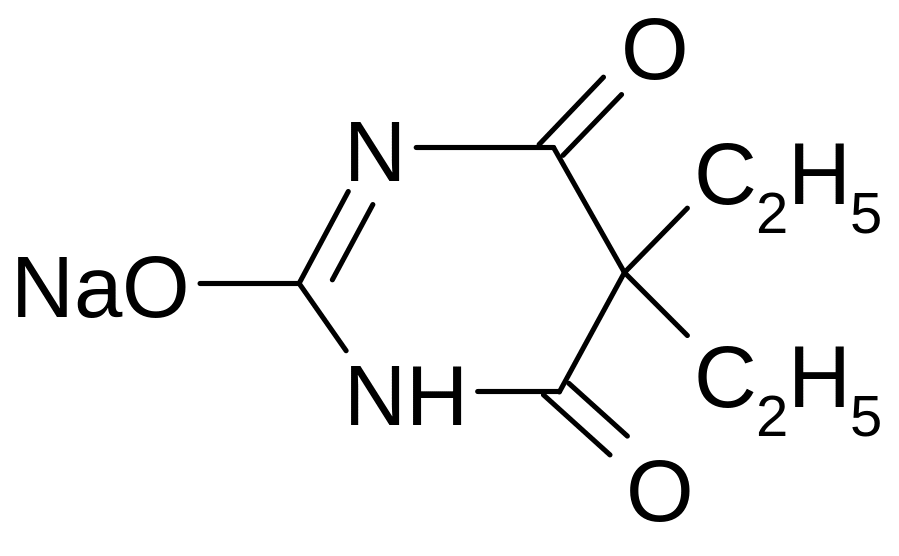 .
.
Барбитал-натрий (МНН)
Barbitalum-natrium
5,5-диэтилбарбитурат натрия
Фармакологическая группа – снотворные средства. Применяется в медицинской практике как снотворное и успокаивающее средство. Благодаря легкой растворимости в воде, действует быстрее, чем барбитал. Также быстрее выводится из организма, менее токсичен. Назначают перед сном.
2. Относится к производным барбитуровой кислоты, или производным пиримидина.
Производные барбитуровой кислоты способны проявлять лактим-лактамную таутомерию:
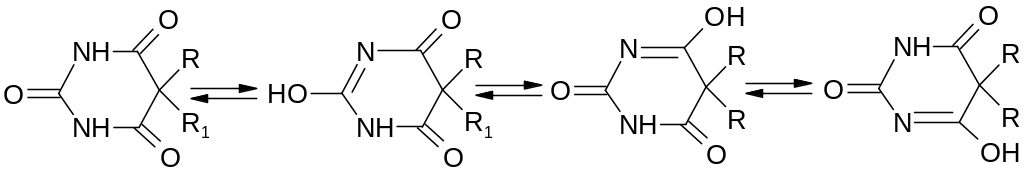
3. Это белый кристаллический порошок, без запаха. Гигроскопичен. Легко растворим в воде, мало растворим в этаноле, практически нерастворим в эфире. Водный раствор барбитала-натрия имеет щелочную реакцию.
Подлинность барбитала-натрия можно установить по ИК-спектру. Для идентификации барбитала-натрия используют химические реакции, основанные на соле- и комплексообразовании с солями тяжелых металлов, сплавлении со щелочами, окислении, нейтрализации натриевых солей, обнаружении ионов натрия и функциональных групп.
Барбитал-натрия образует нерастворимые соли с ионами серебра, ртути (II), меди (II). Эти реакции выполняют в смеси растворов гидрокарбоната и карбоната натрия.
Барбитал-натрия образует с ионом кобальта комплексное соединение, окрашенное в сине-фиолетовый цвет.
С ионами серебра происходит образование однозамещенных (растворимых в воде) и двузамещенных (нерастворимых в воде) солей серебра:
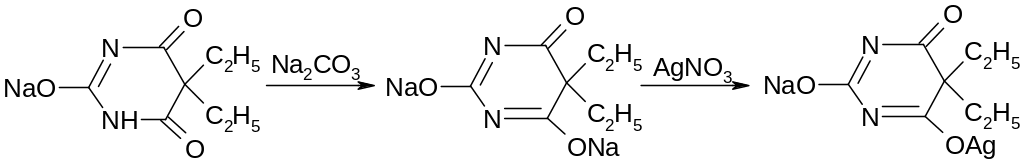
При добавлении избытка нитрата серебра однозамещенная соль превращается в двузамещенную серебряную соль:
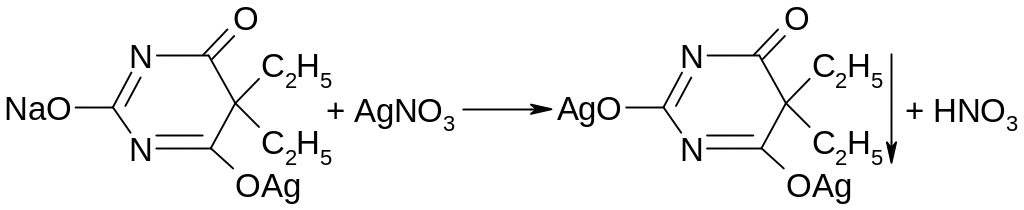
При сплавлении с едкими щелочами разрушается с выделением аммиака (реакция на циклические уреиды):
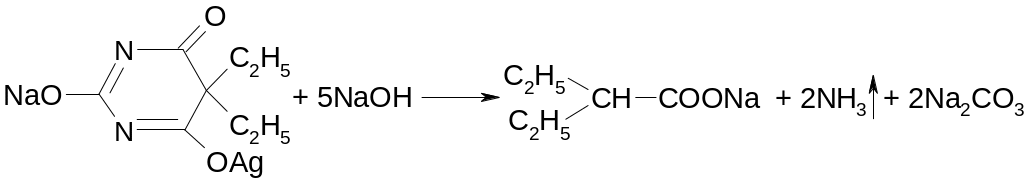
При последующем подкислении хлороводородной кислотой ощущается запах жирной кислоты и выделяется диоксид углерода:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O

Отличают солевые формы барбитуров от кислотных по растворимости. Натриевые соли гигроскопичны, растворимы или очень легко растворимы в воде.
Барбитал-натрия при подкислении разведенной соляной кислотой образует осадок:
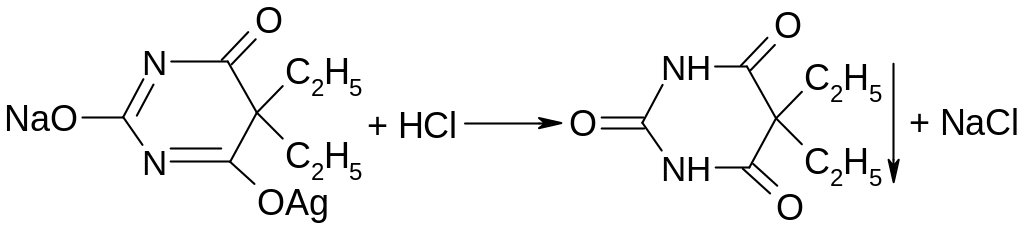
Выпавший осадок барбитала отфильтровывают, промывают и сушат. Определяют температуру плавления.
Ион натрия обнаруживают по окраске пламени (желтый цвет).
4. Для количественного определения барбитала-натрия используют физико-химические методы анализа: УФ-спектроскопию, фотоколориметрию, хроматографию.
Солевые формы барбитуратов определяют количественно методом нейтрализации в присутствии спирта или в среде неводных растворителей.
Б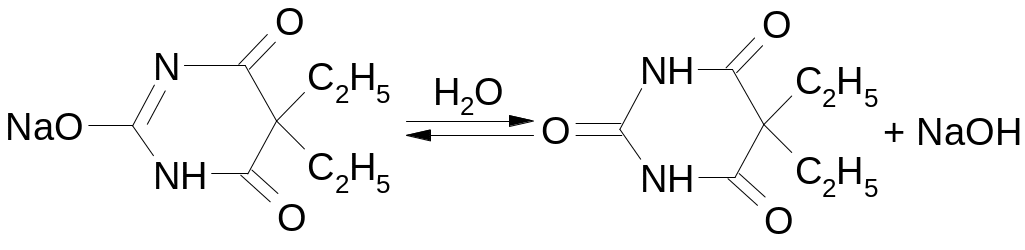 арбитал-натрия
титруют в водной среде 0,1 М раствором
хлористоводородной кислоты по индикатору
метиловому оранжевому до розовой
окраски:
арбитал-натрия
титруют в водной среде 0,1 М раствором
хлористоводородной кислоты по индикатору
метиловому оранжевому до розовой
окраски:
NaOH + HCl → NaCl + H2O
f = 1
Для кислотных форм используют алкалиметрическое титрование в спиртовой среде.
При испытании чистоты барбитал-натрия устанавливают предельное содержание примеси свободной щелочи, метилового спирта и др., которые могут появиться в процессе синтеза. Свободную щелочь определяют методом ацидиметрии.
Наличие примесей устанавливают методом тонкослойной хроматографии. На хроматограмме допускается не более одного постороннего пятна.
