- •Высокомолекулярные соединения (вмс) и их растворы
- •Классификация вмс
- •Способы получения (образования) вмс
- •Конформация полимеров
- •Деформация полимеров
- •Свойства растворов вмс Набухание и растворение вмс
- •Вязкость растворов вмс
- •Осмотическое давление растворов полимеров
- •Устойчивость растворов вмс Растворы вмс как молекулярные коллоидные системы
- •Факторы устойчивости растворов вмс
- •Полиамфолиты
- •Высаливание
- •Коллоидная защита
- •Методы определения фаз в эмульсиях
Осмотическое давление растворов полимеров
Осмотическое давление растворов полимеров, как и у коллоидных растворов, имеет очень малую величину по сравнению с истинными растворами. Это объясня-ется малой численной концентрацией их в растворе из-за большего размера макро-молекул. Однако с увеличением концентрации раствора осмотическое давление растворов полимеров возрастает гораздо больше, чем это следует по закону Вант-Гоффа.
Рис.5. Зависмость осмотического давления раствора от концентрации |
Такое непрямолинейное увеличение осмоти-ческого давления объясняется тем, что макро-молекула благодаря жесткости ведет себя в растворе как несколько более коротких молекул, т.е. самостоятельной подвижной единицей выступает не сама макромолекула, а её сегмент (отрезок цепи). Согласно Галлеру число таких сегментов увеличивается с повышением концентрации. Отсюда следует, что чем гибче макромолекула, тем |
больше осмотическое давление раствора полимера. Для расчёта осмотического давления растворов полимеров Галлер предложил уравнение:
![]()
где М – молекулярная масса полимера, С – концентрация раствора, К – коэффи-циент, учитывающий длину, разветвленность и гибкость макромолекулы полимера.
Из всех коллигативных свойств растворов полимеров осмометрический метод оказался наиболее удобным при определении молекулярной массы полимера. Молекулярную массу полимера определяют графически по данным измерений осмотического давления растворов разной концентрации.
|
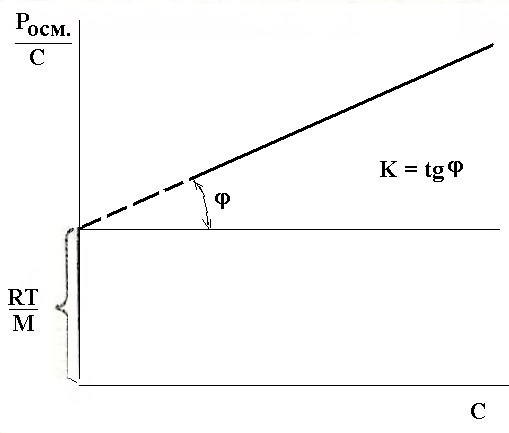
С этой целью уравнение Галлера можно представить в виде уравнения прямой линии, поделив обе части его на концентрацию:
и построить график зависимости Росм./С от концентрации. Отрезок, отсекаемый прямой на оси ординат равен RT/M, а тангенс угла наклона прямой равен К. |
Часть осмотического давления, создаваемого белками (альбумин, глобулины) как ВМС в плазме крови имеет большое физиологическое значение. Это давление называется онкотическим давлением. Его величина составляет 0,04 атм. , тогда как общее осмотическое давление плазмы крови 7,47,8 атм. Онкотическое давление обеспечивает механизм всасывания межклеточной жидкости в капилляры венозной системы. При заболеваниях почек, печени, сопровождающихся потерями белка крови с мочой или недостатком его синтеза, онкотическое давление крови снижается. Это приводит к задержке жидкости в тканях и возникновению отёков. Применяемые при этом растворы альбумина снижают отёки и повышают онкотическое давление.
Устойчивость растворов вмс Растворы вмс как молекулярные коллоидные системы
Растворы ВМС ввиду большого размера макромолекул проявляют свойства, сближающие их с лиофобными коллоидными системами. Макромолекулы, как и коллоидные частицы, имют малую скорость диффузии, не проникают через полу-проницаемые мембраны, образуют аморфные осадки, рассеивают свет, проявляя эффект Фарадея-Тиндаля.
В отличие от коллоидных систем, растворы ВМС являются термодинамически устойчивыми растворами. Образование лиофобных коллоидных систем требует затраты энергии на измельчение или конденсацию вещества, в растворе имеется границы раздела фаз, коллоидные частицы стремятся коагулировать и такие системы термодинамически малоустойчивы. Растворение же полимера происходит самопроизвольно, без затраты энергии, частицы не коагулируют, отсутствует поверхность раздела фаз. Макромолекулы представляют собой обычные клубки, в петли которых свободно проникают молекулы растворителя. Поскольку поперечное сечение макромолекулы соразмерно с молекулами растворителя, макромолекулы полностью окружены растворителем по все длине. Поэтому между растворенным полимером и растворителем отсутствует граница раздела. В связи с отличием устойчивости от лиофобных коллоидов, растворы ВМС выделены как особая группа лиофильных коллоидных систем. Их рассматривают как молекулярные коллоидные системы. Растения, организмы животных построены из ВМС (нуклеиновые кислоты, белки, полисахариды). Поэтому ткани организма проявляют свойства коллоидных растворов. Однако они проявляются более сложным образом и обеспечивают достаточную устойчивость молекулярных систем.