
- •1. Основные понятия в химии
- •Примеры решения задач Пример 1
- •6,021023 Молекул 6 атомов с
- •Упражнения
- •Примеры решения задач Пример 1
- •Примеры решения задач Пример 1
- •Упражнения
- •2. Способы выражения концентраций
- •Пример 2
- •Упражнения
- •3.Коллигативные свойства растворов
- •4. Растворы электролитов и неэлектролитов
- •5. Ионное произведение воды. Водородный показатель.
- •6. Условия протекания химических реакций
- •7. Гидролиз солей
- •8. Гальванические элементы
- •9.Электролиз
- •10. Коррозия металлов
Примеры решения задач Пример 1
Определим эквивалент и эквивалентную массу меди в оксидах Cu2O и CuO.
В оксиде Cu2O медь одновалентна; M (Cu)=64 г/моль
Э(Cu)=1
моль, mэ(Cu)=![]() =64
г/моль
=64
г/моль
В оксиде CuO медь двухвалентна, значит
Э(Cu)=![]() моль, mэ(Cu)=
моль, mэ(Cu)=![]() =32
г/моль
=32
г/моль
Эквивалентная масса сложного вещества равна сумме эквивалентных масс его составных частей. Составными частями молекулы в этом случае следует считать те ее части, которые в неизменном виде переходят из исходных веществ в продукты реакции. Например, эквивалентная масса оксида состоит из эквивалентной массы металла или неметалла и кислорода:
mэ (оксида)=mэ (металла)+mэ (кислорода) (1.12)
Эквивалентная масса соли состоит из эквивалентной массы металла и эквивалентной массы кислотного остатка:
mэ (соли)=mэ (металла)+mэ (кислотного остатка) (1.13)
Эквивалентная масса кислотного остатка равна его молярной массе, деленной на заряд кислотного остатка.
Между массой вещества и его эквивалентной массой существует зависимость:
m=nэmэ , (1.14)
где m масса вещества; nэ количество эквивалентов вещества; mэ эквивалентная масса вещества.
Между количеством и числом эквивалентов данного вещества существует зависимость:
nэ=n/Э, (1.15)
где n количество вещества; nэ число эквивалентов вещества; Э эквивалент вещества.
Примеры решения задач Пример 1
Сколько эквивалентов содержится в 450 г MgSO4?
Решение. По формуле (1.11) вычислим эквивалентную массу сульфата магния:
mэ(MgSO4)=![]()
Воспользовавшись формулой (1.15), рассчитаем число эквивалентов:
nэ=![]() =7,5
моль
=7,5
моль
Пример 2
Сколько грамм составляют 7 эквивалентов AgNO3?
Решение. По формуле (1.11) вычислим эквивалентную массу нитрата серебра:
mэ(AgNO3)=![]() =170
г/моль
=170
г/моль
Преобразовав формулу (1.14), рассчитаем массу соли:
m=nэmэ=7170=1190 г
Упражнения
Найдите значение эквивалента гидроксида кальция.
Сколько эквивалентов содержится в 320 г CuSO4?
3. Вычислите эквиваленты и эквивалентные массы H2SO4 и Al(OH)3 в реакциях, выраженных уравнениями: a) H2SO4+KOH=KHSO4+H2O; б) H2SO4+Mg=MgSO4+H2; в) Al(OH)3+HCl=Al(OH)2Cl+H2O; г) Al(OH)3+3HNO3=Al(NO3)3+3H2O
Одно и тоже количество металла взаимодействует с 0,2 г кислорода и с 3,2 г галогена. Вычислите эквивалентную массу галогена.
В реакцию с магнием вступило три эквивалента кислорода. Сколько граммов оксида магния образовалось?
2. Способы выражения концентраций
Количество вещества, растворенного в заданном количестве растворителя или раствора, выражают через концентрацию. Концентрацию раствора можно охарактеризовать качественно или количественно. Для качественного описания концентрации используются такие понятия, как разбавленный и концентрированный раствор. О растворах, с относительно низкой концентрацией растворенного вещества, принято говорить, как о разбавленных, а о растворах, с относительно высокой концентрацией, как о концентрированных.
Компонент раствора, физическое состояние которого сохраняется при образовании раствора, принято считать растворителем. Например, при смешении хлорида натрия (твердое вещество) с водой получается жидкий раствор. Поэтому воду считают растворителем, а NaCl растворенным веществом. Если все компоненты раствора находятся в одинаковом физическом состоянии, то компонент, присутствующий в большем количестве, считается растворителем.
2.1 Молярную концентрацию раствора определяют как число молей вещества, растворенного в литре раствора:
См=![]()
Например, в каждом литре 1,50 молярного раствора (пишется 1,50 М) содержится 1,50 моля растворенного вещества. Чтобы приготовить один литр 0,150 М раствора сахарозы C12H22O11 в воде, нужно взять 0,150 моля С12H22O11. Это количество твердой сахарозы (51,3 г) сначала растворяют в менее чем одном литре воды, а затем полученный раствор разбавляют до окончательного объема 1 л. С этой целью обычно пользуются мерной колбой, имеющей метку, в которую можно налить точно известный объем жидкости.
С помощью молярной концентрации объем можно перевести в моли или моли в объем:
а) вычислить число молей HNO3 в 2 л 0,200 М раствора HNO3.
n (HNO3)=2,0
л раствора0,200![]() =0,40
моля HNO3
=0,40
моля HNO3
б) вычислить объем 0,30 М раствора HNO3, в котором содержится 2,0 моля HNO3:
V (раствора)=2,0
моля![]() =6,7
л раствора
=6,7
л раствора
Пример
Сколько граммов Na2SO4 требуется для приготовления 350 мл раствора Na2SO4 c концентрацией 0,50 М?
Решение.
См
(Na2SO4)=![]() .
.
Следовательно,
n
(Na2SO4)=0,350
л раствора0,50![]() =0,175
моля Na2SO4.
=0,175
моля Na2SO4.
Поскольку один моль Na2SO4 имеет массу 142 г, т.е. М (Na2SO4)=142 г/моль, то m (Na2SO4)=nM=0,175142=24,8 г
2.2 Процентная концентрация
Ср=![]() 100,
%
100,
%
Пример
Приготовлен раствор, содержащий 6,9 г NaHCO3 в 100 г воды. Какова процентная концентрация растворенного вещества в этом растворе?
Решение.
Ср=![]() 100=
100=![]() 100=6,5%
100=6,5%
Масса раствора это сумма масс растворителя и растворенного вещества.
3.2 Мольная доля компонента раствора (Х) определяется уравнением:
Х=![]()
Сумма мольных долей всех компонентов раствора должна быть равна 1.
Пример
Вычислите мольную долю HCl в растворе соляной кислоты, содержащем 36 % HCl по массе.
Решение. Допустим, что имеется 100 г раствора (если исходить из какого-то другого количества раствора, то конечный результат будет тем же; это легко проверить, но расчет усложнится). Тогда в растворе должно содержаться 36 г HCl и 64 г H2O.
n(HCl)=![]() =
=![]() =0,99
моля
=0,99
моля
n(H2O)=![]() =3,6
моля
=3,6
моля
Х(HCl)=![]() =
=![]() =0,22.
=0,22.
4.2. Моляльная концентрация или моляльность раствора определяется как число молей растворенного вещества в кг растворителя, а размерность этой концентрации обозначается Мл.
Cg=![]()
Следует обратить внимание на различия между молярностью и моляльностью: при определении моляльности используется масса растворителя, при определении молярности – объем раствора. В растворе, моляльность которого равна 1,50, т.е. в 1,50 Мл растворе содержится 1,50 моля растворенного вещества на каждый кг растворителя. Если растворителем служит вода, моляльность и молярность разбавленного раствора численно почти совпадают, потому что 1 кг растворителя представляет собой почти то же самое, что и 1 кг раствора, а объем 1 кг водного раствора приблизительно равен 1 л.
Пример 1
Раствор какой моляльности получается при растворении 5,0 г толуола (C7H8) в 225 г бензола (С6Н6).
Решение.
![]() ;
;
![]() .
.
Пример 2
Исходя из того, что плотность раствора, содержащего 5,0 г толуола и 225 г бензола, равна 0,876 г/мл, вычислите концентрацию этого раствора, выразив ее как: а) молярную концентрацию; б) мольную долю растворенного вещества; в) процентную концентрацию растворенного вещества.
Решение. а) суммарная масса раствора равна массе растворителя плюс масса растворенного вещества:
mраствора=5,0+225=230 г.
Зная массу раствора и его плотность, можно вычислить объем раствора:
Vраствора=![]() =
=![]() =263
мл = 0,263 л.
=263
мл = 0,263 л.
Сведения о плотности раствора нужны для того, чтобы связать между собой его молярность и моляльность, поскольку первая выражается через объем, а вторая через массу. Кроме того, чтобы вычислить молярность и моляльность раствора, необходимо знать число молей растворенного в нем вещества:
n(C7H8)=![]() =
=![]() =0,054
моля.
=0,054
моля.
Молярность раствора равна числу молей вещества, растворенного в 1 л раствора:
См=![]() =
=![]() =0,21
М.
=0,21
М.
б) для вычисления мольной доли растворенного вещества, рассчитаем количество молей каждого из компонентов раствора:
n(C6H6)=
![]() =
=![]() =2,88
моля, n(C7H8)=0,054
моля.
=2,88
моля, n(C7H8)=0,054
моля.
Мольную долю растворенного вещества вычислим по следующей формуле:
X(C7H8)=![]()
в) поскольку процентная концентрация растворенного вещества равна отношению массы растворенного вещества к суммарной массе раствора, то:
Cp=![]()
Нормальная концентрация или нормальность раствора (обозначается буквой н.) определяется числом эквивалентов вещества, растворенного в 1 л раствора.
Сн=![]()
Нормальная концентрация раствора всегда представляет собой целое число, кратное молярной концентрации раствора. В окислительно-восстановительных реакциях целочисленный коэффициент пропорциональности между молярностью и нормальностью раствора равен числу электронов, присоединяемых или теряемых одной формульной единицей вещества. В кислотно-основных реакциях этот целочисленный множитель равен числу ионов Н+ или ОН-, которые создаются одной формульной единицей вещества.
Пример
Каковы молярная и нормальная концентрации раствора H2SO4, приготовленного растворением 5.00 г H2SO4 в таком количестве воды, чтобы получилось 200 мл раствора?
Решение.
1) М(H2SO4)=98
г/моль; 2)![]() ;
;
3)
![]() .
.
Так как одна молекула H2SO4 дает два иона водорода, в одном моле этой кислоты содержится 2 химических эквивалента, и поэтому нормальность раствора вдвое превышает его молярность, т.е. равна 0,510н.
1)
Э(H2SO4)=![]() ;
2)
;
2)
![]() ;
3) Cн=
;
3) Cн=![]()
6.2 Титр определяется количеством грамм вещества, растворенным в 1 мл раствора.
Т=![]() ,
г/мл
,
г/мл
7.2 Равновесная концентрация
Если реагенты и продукты реакции находятся во взаимном контакте, химическая реакция может достичь состояния динамического равновесия, в котором прямая и обратная реакции протекают с одинаковыми скоростями. Это состояние называется химическим равновесием. Свойства равновесной системы не меняются с течением времени. Для такой системы отношение произведения концентраций всех продуктов к произведению концентраций всех реагентов, каждая из которых возведена в степень, равную стехиометрическому коэффициенту данного участника реакции в ее полном химическом уравнении, называется константой равновесия К.
jA+kB![]() pC+qD
pC+qD
K=![]() (7.2.1)
(7.2.1)
Константа равновесия зависит от температуры, но на нее не влияют не изменения относительных концентраций реагирующих веществ, ни давление в реакционной системе, ни наличие в ней катализатора.
При использовании молярных концентраций константу равновесия обозначают символом Кс, а при измерении концентраций парциальными давлениями (в атмосферах) константу равновесия обозначают символом Кр.
jA+kB dAB
Kp=![]() (7.2.2)
(7.2.2)
Константы Кс и Кр связаны между собой соотношением:
Kp=Kc(RT)![]() ,
(7.2.3)
,
(7.2.3)
где изменение числа молей газа в реакции.
Большое значение константы равновесия указывает на то, что в равновесной смеси должно содержаться больше продуктов, чем реагентов. Малая величина константы равновесия означает, что равновесие сдвинуто в сторону реагентов.
Пример
В одном из экспериментов немецкий химик Фриц Габер и его сотрудники в начале XX века вводили в реакционный сосуд смесь водорода и азота, а затем ждали, пока в системе не установится равновесие при 472°С. После анализа в равновесной смеси газов было обнаружено 0,1207 М Н2, 0,0402 М N2 и 0,00272М NH3. Вычислите по этим данным константы равновесия Кс и Кр реакции:
N2(г.)+3Н2(г.) 2NH3(г.)
Решение.
а) Кс=
б)
в этой реакции из 4 молей газообразных
реагентов (1N2+3H2)
образуется 2 моля газообразных продуктов
(2NH3).
Следовательно,
![]() n=24=
2
(любую
величину, обозначаемую символом
,
всегда получают вычитанием из результата,
в рассматриваемом случае данных для
продуктов, исходного значения, т.е.
данных для реагентов).
n=24=
2
(любую
величину, обозначаемую символом
,
всегда получают вычитанием из результата,
в рассматриваемом случае данных для
продуктов, исходного значения, т.е.
данных для реагентов).
Абсолютная температура эксперимента Т=273+472=745 К
Воспользуемся
значением универсальной газовой
постоянной
R=0,0821
![]() .
.
Кр=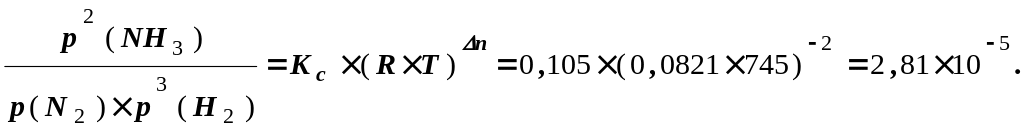
При
вычислении констант равновесия
соответствующие концентрации можно
подставлять вместе с единицами измерения,
и тогда константа равновесия К
приобретет
определенную размерность. Например,
для реакции N2O(г.)
2NO2(г.)
имеем К=![]() Если в данном случае концентрацию
веществ выразить в молях, константа
равновесия примет размерность
Если в данном случае концентрацию
веществ выразить в молях, константа
равновесия примет размерность
![]() ,
а если концентрацию выразить в атмосферах,
константа равновесия имеет размерность
,
а если концентрацию выразить в атмосферах,
константа равновесия имеет размерность
![]() Выражая константы равновесия в единицах
определенной размерности, мы тем самым
указываем и единицы, в которых выражены
концентрации, а это имеет свои удобства.
Тем не менее чаще константы равновесия
записывают как безразмерные величины.
Выражая константы равновесия в единицах
определенной размерности, мы тем самым
указываем и единицы, в которых выражены
концентрации, а это имеет свои удобства.
Тем не менее чаще константы равновесия
записывают как безразмерные величины.
7.2.1. Гетерогенные равновесия
Во многих важных равновесных системах все вещества находятся в одинаковом фазовом состоянии. Такие равновесные системы называются гомогенными. Но равновесие может устанавливаться и между веществами, которые находятся в разных фазовых состояниях, и в таком случае говорят о гетерогенном равновесии. В качестве примера рассмотрим разложение карбоната кальция:
CaCO3(тв.)![]() СаО(тв.)+СО2(г.)
СаО(тв.)+СО2(г.)
В этой системе газ находится в равновесии с двумя твердыми веществами. Если написать выражение для константы равновесия так, как мы это делали до сих пор, то получим:
K=![]() .
.
Так как карбонат и оксид кальция присутствуют в системе в виде твердых веществ, их концентрации остаются постоянными. Число молей твердого вещества, приходящееся на литр его объема, не зависит от того, много или мало этого вещества имеется в системе. Концентрацию чистого жидкого или твердого вещества можно выразить через отношение плотности к молекулярной массе:
![]()
Плотность чистого жидкого или твердого вещества при любой заданной температуре постоянна, а при изменении температуры меняется очень незначительно. Поэтому можно с удовлетворительной точностью считать эффективную концентрацию чистого жидкого или твердого вещества постоянной. С практической точки зрения результат этой продцедуры эквивалентен тому, как если бы мы в выражении для константы равновесия условно приняли концентрации твердых веществ равными единице.
K=[CO2]
Пример
Напишите выражение для константы равновесия каждой из следующих реакций:
CO2(г.)+Н2(г.) СО2(г.)+Н2О(ж.)
б)SnO2(тв.)+2СО(г.) Sn(тв.)+2СО2(г.)
Решение. а) поскольку вода участвует в данной реакции в виде чистой жидкости, ее концентрацию не следует включать в выражение для константы равновесия:
K=![]()
б) поскольку SnO2 и Sn являются чистыми твердыми веществами, они не входят в выражение для константы равновесия:
K=![]()
7.2.2 Кажущаяся константа равновесия
Допустим, что смесь 2,0 моля Н2, 1,00 моля N2 и 2,00 моля NH3 поместили в сосуд объемом 1 л при температуре 472 К. Будет ли реакция между N2 и Н2 давать дополнительное количество NH3? Подставив начальные концентрации N2, H2 и NH3 в выражение для константы равновесия реакции, найдем:
K
=
В примере раздела 7.2 было установлено, что при заданной температуре Кс=0,105. Следовательно, для того чтобы система приблизилась к равновесию,
отношение
 должно
уменьшиться с 0,500 до 0,105. Это произойдет
при уменьшении [NH3]
и
увеличении [N2]
и
[H2].
Следовательно, по мере образования N2
и
Н2
из NH3
реакция
будет смещаться в сторону установления
равновесия, другими словами, реакция
должна протекать справа налево.
должно
уменьшиться с 0,500 до 0,105. Это произойдет
при уменьшении [NH3]
и
увеличении [N2]
и
[H2].
Следовательно, по мере образования N2
и
Н2
из NH3
реакция
будет смещаться в сторону установления
равновесия, другими словами, реакция
должна протекать справа налево.
Подставляя произвольные концентрации реагентов и продуктов в выражение для константы равновесия, мы получим кажущуюся константу равновесия, которую обозначают буквой Q. Кажущаяся константа равновесия становится равной истинной константе равновесия К только тогда, когда концентрации всех компонентов реакционной системы достигнут своих равновесных значений, т.е. Q=K только при равновесии. Если кажущаяся константа равновесия больше К, то вещества, указанные в правой части химического уравнения реакции, должны реагировать с образованием веществ, указанных в его левой части, другими словами, реакция приближается к равновесному состоянию, смещаясь справа налево. Следовательно, если Q>K, реакция сдвигается справа налево. И наоборот, если Q<K, реакция приближается к равновесному состоянию с образованием дополнительного количества продуктов (смещается слева направо).
7.2.3 Вычисление равновесных концентраций
Если нам известна константа равновесия некоторой реакции, то мы можем вычислить концентрации веществ в реакционной смеси при равновесии. Сложность такого расчета зависит от нескольких факторов: сложности химического уравнения реакции и от того, какие концентрации уже известны. Общий характер подобных расчетов станет понятен после решения следующих примеров.
Пример 1
При
каком парциальном давлении NH3
находится в равновесии с N2
и
Н2
при 500°С, если равновесное парциальное
давление Н2
равно 0,733 атм., а N2
0,527 атм.
При 500°С для реакции N2(г.)+3Н2(г.)
2NH3(г.)
константа равновесия Кр=1,45![]() 10-5.
10-5.
Решение.
Кр=
Поскольку значения Кр, р(N2) и р(Н2) заданы, из выражения для константы равновесия можно найти р(NH3):
p2(NH3)=Kp![]() (1,45
(1,45![]() ,
,
откуда
р(NH3)=![]()
