
- •1. Гендік терапия
- •1.3. Гендік терапияның принциптері
- •1.4. Онкологиялық аурулардың гендік терапиясы
- •1.5. Тұқымқуалаған аурулардың диагностикасы мен гендік терапиясы
- •1.6. Тұқым қуаламаған аурулардың гендік терапиясы
- •1.7. «Адам геномы» бағдарламасы
- •2. Клеткалық терапия
- •2.1. Клеткалық терапияның тарихы
- •Алмастыратын ағазатерапияның белгілі хирургиялық тәсілдердің бірі ағзалар, тіндер, клеткалар, клеткаішілік құрылымдар және олардың компартменттердің трансплантациясы (сур. 8).
- •2.2. Дін клеткалары, алу технологиялары және қолдануы
- •3. Биосенсорлар мен биочиптер
- •3.1. Биосенсорлар, құрылысы және қолдануы
- •3.2. Гельді биочиптер
- •3.3. Днқ биочиптері
- •4. Наномедицина
- •4.1. Нанобөлшектер
- •4.2. Медициналық диагностикадағы нанобөлшектер
- •4.3. Дәрілерді қажетті орнына жеткізу
- •4.4. Нанодәрілер
- •4.5. Жаңа нанобиотехнологиялар
- •5. Адамның рекомбинантты
- •5.1. Рекомбинантты нәруыздар
- •5.2. Инсулин, бөліп алу технологиясы
- •5.3. Адамның өсу гормоны, бөліп алу технологиясы
- •5.4. Интерферондар
- •5.5. Интерлейкиндер. Эритропоэтин
- •5.6. Өсімдіктерде экспрессияланатын рекомбинантты нәруыздар
- •5.7. Сүтқоректілер клеткаларында экспрессиялайтын рекомбинантты ақуыздары
- •6. Диагностика және терапиядағы моноклонды антиденелер
- •6.1. Антиденелердің сипаттамасы
- •6.2. Антиденелерді бөліп алу технологиялары
- •6.3. Терапиялық антиденелер
- •6.4. Диагностикалық антиденелер
- •7. Ферменттер
- •7.1. Ферменттердің сипаттамасы
- •7.2. Ферменттерді алу технологиясы
- •7.3. Медицинада ферменттердің қолданылуы
- •8. Антибиотиктер
- •8.1. Антибиотиктер сипаттамасы
- •8.2. Микроорганизмдер түзетін антибиотиктер биосинтезінің метаболизм жолдары
- •8.3. Микроорганизмдер - антибиотиктердің өндірушілері
- •8.4. Антибиотиктер өндірушілердің селекциясы
- •8.5. Антибиотиктердің микробиологиялық синтезі
- •8.6. Пенициллиндер
- •8.9. Саңырауқұлақтарға қарсы антибиотиктер
- •9. Вакциналар
- •9.1. Вакциналардың сипаттамасы
- •9.2. Вакциналар алу технологиясы
М Е Д И Ц И Н АЛ Ы Қ
Б И О Т Е Х Н О Л О Г И Я
А с т а н а - 2009
М А З М Ұ Н Ы
Алғы сөз
1. Гендік терапия
Гендік терапияның технологиялары
ДНҚ-диагностика
Гендік терапия принциптері
Онкологиялық аурулардың гендік терапиясы
Тұқым қуалаған аурулардың диагностикасы және гендік терапиясы
«Адам геномы» бағдарламасы
Клеткалық терапия
Клеткалық терапияның тарихы
Дін клеткалары, алу технологиялары және қолданылуы
Биосенсорлар және биочиптер
Биосенсорлар, құрылысы және қолданылуы
Гельді биочиптер
ДНҚ-биочиптер
Наномедицина
Нанобөлшектер
Медициналық диагностикасындағы нанобөлшектер
Дәрілерді нақты орнына жеткізу
Нанодәрілер
Жаңа нанобиотехнологиялар
Адамның рекомбинантты нәруыздары
5.1.Рекомбинатты нәруыздары
5.2.Инсулин, алу технологиясы
5.3.Адамның өсу гормоны, алу технологиясы
5.4.Интерферондар
5.5.Интерлейкиндер, эритропоэтин
5.6.Өсімдіктерге экспрессиялайтын рекомбинантты нәруыздар
5.7.Сүтқоректілер клеткаларына экспрессияланатын рекомбинантты нәруыздар
Терапия мен диагностикадағы моноклонды антиденелер
6.1. Антиденелер сипаттамасы
6.2. Антиденелер алу технологиялары
6.3. Терапиялық антиденелер
6.4. Диагностикалық антиденелер
Ферменттер
Ферменттер сипаттамасы
Ферменттерді алу технологиялары
Медицинада ферменттерді қолдану
Антибиотиктер
8.1.Антибиотиктер
8.2. Микроорганизмдердің антибиотиктер биосинтезінің метаболизм жолдары
8.3. Микроорганизмдер – антибиотиктер өндірушілері
8.4. Антибиотиктер өндірушілердің селекциясы
8.5. Антибиотиктердің микробиологиялық синтезі
8.6. Пенициллиндер, ампициллиндер, тетрациклиндер, фторхинолондар
8.7. Пептидті антибиотиктер
8.8. Өспелерге қарсы антибиотиктер
8.9. Саңырауқұлақтарға қарсы антибиотиктер
Вакциналар
Вакциналар сипаттамасы
Вакциналар алу технологиялары
Пробиотиктер
10.1. Пробиотиктер, қасиеттері, алуы
10.2. Пребиотиктер
Алғы сөз
Медициналық биотехнология – бұл адамның аурулар диагностикасында, емдеуіне және профилактикасында тірі жүйелер (организм, тіндер, клеткалар, олардың компоненттері мен метаболиттері) қолдануына негізделген технологиялар. Микробтық клеткалар және олардың метаболиттері, фитопрепараттар, жануар текті клеткалар мен тіндер медициналық практикада, оның дамуы мен жетілдірілуіне аса маңызды орын алады. Егер бұрын медициналық препараттар толық микробтық клеткалар (вакциналар, диагностикумдар, пробиотиктер) және олардың туындылары (антибиотиктер, ферменттер, аминқышқылдар, дәрумендер) негізінде жасалған болса, ал бүгін, рекомбинантты ДНҚ технология жетістіктерімен микроорганизмдер адамның гормондары мен цитокиндерін түзеді (инсулин, интерлейкиндер, интерферондар және т.б.), ДНҚ-вакциналар өнделуде.
Жануарлар текті және адамның клеткалары мен тіндері көптеген моноклонды антиденелер, ішкі ағзалар, сүйек кемігі трансплантация арқылы жақсы белгілі. Қазіргі уақытта трансгенді жануарлар сүтімен адамның терапиялық нәруыздары өндіріледі, in vitro-да аутологиялық адамның тіндері мен ағзаларын қалпына келтіру үшін регенеративті медицина дамып келеді. Емдеуге және диагностикаға (әсіресе онкологиялық аурулар, тұқым қуалаған патология, вирустық инфекция) нанобөлшектер мен биочиптер қолдану негізінде технологиялар енгізіліп жатыр. Молекулалық биология, молекулалық генетиканың заманауи әдістері бөлек молекулалармен операция жасауға, клеткаішілік манипуляциялар орындауы микроэлектроника, биоинженерия, компьютерлік технологияның медицинада қолдану жетістіктеріне жол ашылды.
Медициналық практикада келесі биотехнологиялық процестер қолданылады:
- ферментациялық – антибиотиктер, дәрумендер, ферменттер, аминқышқылдар және т.б. өндіру; биосинтез және биотрансформация;
- иммунобиотехнология – вакциналар, диагностикумдар, аллергендер, антиденелер, соның ішінде моноклонды антиденелер (гибридомды технология);
- клеткалық технологиялар – клеткалы терапия, тіндік инженерия, in vitro-да ұрықтандыру;
- рекомбинантты ДНҚ технологиясы – гендік терапия, адамның рекомбинантты нәруыздар өнімі;
- нанобиотехнологиялар, аналитикалық биотехнологиялар – биочиптер мен биосенсорлар;
- фармбиотехнологиялар – дәрілік өсімдіктер негізіндегі биопрепараттар.
Осы кітапта кейбір қазіргі уақыттағы заманауи және классикалық биомедициналық технологиялар келтірілген.

1. Гендік терапия
ДНҚ молекула құрылысын ашқан
Д.Уотсонның геномы секвенирленуі
2 ай бұрын жасалынды және оның
құны 1 млн. доллар болды, ал бірінші
геномды талдауы 10-12 жылға созылып
3 млрд. доллар жұмсалды.
Гендік терапияның технологиясы
Гендік терапия – бұл адам ауруларын емдеуіне қолданатын технологиялар, организмнің қандай да болмасын тіндері мен ағзалары клеткаларының қызметі зақымданған гендерге қосымша, оларды ауыстырып салатын немесе әсерін бәсендететін гендер емдік объект ретінде қолданылады. Тұқымқуалайтын және тұқымқуаламайтын аурулар (соматикалық және жұқпалы), онкологиялық аурулар құрылымды және реттеуші гендердің функциялары бұзылғанымен байланысты. Тұқымқуалатын аурулардың түбірінде жасушалар геномының бұзылыстары кездеседі (гемофилия, Паркинсона ауруы және т.б.). Басқа аурулар дамуы гендік бейімділік пен фенотиптік факторлардың (диабет, гипертониялық ауруы, онкопатология және т.б.) қосарласып әсер етуінен болады.
Гендік терапия гендік инженерия, рекомбинантты ДНҚ технология әдістеріне негізделген: нақты мақсатты гені(гендері) бар гендік конструкцияны құрастырып науқас организмге ендіру; жаңадан құрастырылған гендік конструкциялар дефектті генді қалпына келтіреді немесе оны ауыстырады, жетілген ген өнімін экспрессиялайды немесе мутацияланған геннің функциялық белсенділігін блокадалайды. Айта кету керек, қандай да болмасын барлық аурулар гендердің бұзылған қызметтеріне байланысты, яғни негативті мутациялармен.
Гендік терапия бір молекулалық медицина технологиясы ретінде қалай да болмасын ген функциясын бақылауын қалпына келтіруге бағытталған. Бір жағдайда науқас клеткалар қандай-да болмасын бір геннің функциясын жоғалтқанда, оны қалпына келтіру керек. Осы жағдайда организмге генді физикалық жолмен тасымалданады да әрі қарай клеткаға жеткізіледі. Басқа жағдайда, гендердің қызметтері шектен тыс байқалған болса, олардың гиперактивтілігін бәсендету керек. Дефектті геннің коррекциясы (ДНҚ бір бөлігін өзгерткен мутацияларда), дефектті генді сау генге ауыстыру, нормадағы геннің экспрессиясын күшейту, блокталған геннің экспрессиясын қалпына келтіру немесе ауырған геннің экспрессиясын блокадалау әдістерін зерттеп өндеу. Генді терапияда жиі терапиялық генді ендіру әдісі қолданылады. Гендік коррекцияның технологиялық қиыншылықтары болғандықтан, қазіргі уақытта «науқас» генді сауықтыру үшін клиникалық практикада жойылған функцияны ауыстыруына ауру организмге «сау» терапиялық генді ендіруге негізделген технологиялар зерттеліп іске асырылып жатыр.
Гендік терапия дамуының алғашқы кезеңінде және клиникалық практикада қолданылып жатыр. Айта кету керек, әр адамның геномы бірдей гендер жиынтығынан құралғанымен, олардың гендік жазылымы өзгеше болады. Айырмашылығы орташа ген жазбасының «әріптері» мыңына 1 нуклеотид, яғни 0,1% тен. Клеткада нәруыз синтезін кодтайтын құрылымды гендер саны 3%, ал қалған гендер реттеуші және басқа қызметтер атқарады. Дегенмен, нәтижелі гендік терапия үшін ген(дердің) құрылымы және функциясы туралы білімнен басқа, тағы динамикалық генаралық, ассоциативті өзара қарым-қатынасты, организмнің қандай да болмасын функциясын іске асыратын гендік реттеу жілісін айқындайтын технологиялар туралы білімдер маңызды.
Рекомбинантты ДНҚ технологиясы құрылғандай, гендік терапия технологиясы қалыптасуының алғы шарттары вирустық трансфекция жайіті, табиғатта вирустар клетка ішіне енуі және олардың геномына интеграциялану туралы зерттеулер негіз болды. Гендік терапия технологиясының жетістіктері адам геномы секвенирлену және карталану қорытындыларына негізделген. Осы қорытындылар «Адам геномы» бағдарламаны жүзеге асыру барысында, протеомика, бионанотехнологиялар, биоинформациялық технологиялар және т.б. салалары бойынша заманауи мәліметтеріне сұйенеді. Гендік терапияның өзектілігіне қазіргі уақытта атақты танымал алты халықаралық журналдар жарық береді, осы технологияларды жетілдіру үшін жүздеген биотехнологиялық компаниялар гендік терапия бойынша 600 астам халықаралық проектерді іске асырады, финанстық көлемі миллиардтар долларлармен есептелінеді.
Гендік терапияның стандартты технологиясы келесі кезеңдерден құралған:
- науқас организмнің нысана-клеткасына трансфекциялау үшін экзогенді гендік материалды дайындау;
- осы ДНҚ фрагментін адено-, ретровирустар, плазмидалар, липосомалар және т.б. қолдану негізінде жасалған векторлық жүйеге енгізеді;
- науқас организмнің нысана-клеткасына мақсатты генді алып келетін векторды ex vivo немесе in vivo-да трансфекциясы келесі бір ізділікпен жүргізіледі: экспериментте немесе зертхана жануарларына генді конструкцияны клиника алды сынақтар жүргізіледі, кейін өз еркімен қатысқандарға сынақ жасау, соңында, тек клиникалық сынақтар хаттамалары бекітілгеннен кейін науқас адамдарға енгізеді.
Сонымен, гендік терапияның стандартты сызбанұсқасы смыслдық (нәруызды кодтайтын) және геннің реттеуші бөлігі бар толығымен жұмыс істейтін (экспрессиялайтын) гендік конструкцияны құрастырумен басталады; кейін нысана-клеткаға конструкцияланған генді жеткізетін вектор құрастырылады, соңында, нысана-клеткаға трансфекция (дайындалған конструкцияға ауыстырып салу) жасау. Экспериментте in vitro және in vivo-да трансфекция қорытындысы талқыланады. Оң нәтижелі қорытындыда бағдарлама ұсынылады және клиникалық сынақтар хаттамалары бекітіледі.
Гендік терапияның жіктелуі
Нысана клеткалар типі бойынша |
Векторлар типі бойынша |
||||
Фетальді соматикалық |
Биологиялық (адено-, ретровирустар) және т.б. |
Физикалық (электропорация, баллистика) |
|||
Генді енгізу тәсілі бойынша |
Гендік терапия типі бойынша |
||||
еx vivo |
in vivo |
ауыстыру |
экспрессияны күшейту |
тежеу |
|
Нысана-клеткалар типі бойынша
Фетальді гендік терапия кезінде бөгде ДНҚ ерте даму сатысында зигота немесе ұрыққа ендіреді. Нәтижесінде енгізген материал реципиенттің барлық клеткаларына түседі (және де жыныс клеткаларына, яғни келешекте ұрпаққа гендік ақпаратты тасымалдайды); гендік конструкцияны амнион қуысына енгізеді, оны ұрықтың қанайналымы жолы арқылы кіндікшенің көк тамыры арқылы жеткізеді. Фетальді гендік терапия әдістері зертхана тышқандарына сынақталған, ал клиникада әзір қолданылмайды.
Соматикалық гендік терапияда гендік материалды тек соматикалық клеткаларға енгізеді және олар жыныс клеткаларына берілмейді. Соматикалық нысана-клетканы қатерлі ісікті, жұқпалы, тұқым қуалайтын және басқа аурулардың еміне қолданады. Зақымданған тіндер мен ағзалар клеткаларын бөліп алып организмнен тыс терапиялық гені бар гендік конструкцияға трансфекцияланады (ex vivo) немесе терапиялық гені бар гендік конст-рукцияны жүйелі түрде қантамыр арнасына (in vivo), немесе жергілікті - өкпе тініне аэрозольмен, өспе тініне инъекция арқылы және т.б. (in situ) енгізіледі.
Векторлар типі бойынша
Гендік терапияның нәтижелі болу жәйті бұл нақты жеткізу, яғни нысана-клеткаға бөгде генді трансфекциялау, олардың осы клеткаларда ұзақ қызмет атқаруы және геннің қалыпты қызметін қалыптастыру (сур.1). Түрлі тәсілмен тасымалданған трансдукцияланған бөгде ДНҚ нәтижелі трансфекциясы және нысана-клетканың ДНҚ интеграциялану қабілеттігі әртүрлі болып келеді. Терапиялық эффект беретін жаңа гендік материалды индивидтің нысана-клеткасына жеткізу үшін векторлар қажет. Клеткаға ДНҚ фрагментің (генді) тасымалдауына вектор ретінде қолданады:
- вирустарды (ретровирустар, аденовирустар, аденоассоциирленген және басқа вирустар);
- липосомалар немесе тіндік клеткалардың нақты типтеріне ұқсас (лиганд-рецепторлы әдіс) арнайы конструкцияланған нәруыздық және пептидті векторлар;
- физикалық әдістер (электропорация, баллистикалық трансфекция және басқалар).
ДНҚ вирустық ДНҚ вирустың нәруыз қабаты ядро клеткалық ДНҚ мРНҚ

Сурет 1. Клеткаға геннің трансформациясы мен трансдукциясының сызба суреттемесі
( Баев А.А., 1990)
Вирустық векторларды немесе вирустық жүйелігіне, белсенді трансдукциясына, ал кей жағдайда бөгде гендердің нысана-клеткасында ұзақ эспрессиясына негізделген гендік конструкциялар басқа векторларға қарағанда жиі қолданылады. Соның ішінде 40% жағдайда аденовирустарды қолданады, 30% - ретровирустарды, 16% - аденоассоциирленген вирустар, 10% - қарапайым герпес вирусы, 4%- лентивирустар, папиллома вирусы және басқалар. Вирустар клетканы инфицирлейді және клондалған ДНҚ фрагментімен нысана-клетка геномына жеңіл интеграцияланады.
Гендік-инженерлік әдістер көмегімен вирустан векторды конструкциялану үшін:
- вирустық капсид синтезін кодтайтын жүйелерді қалдырады. Мысалы, «пакеттегі» ретровирусты векторлар қолданады (сур.2), осы жағдайда вектор ретінде терапиялық генге трансфекцияланатын және вирустың капсидін кодтайтын ген қолданады және де ескеру қажет, осылардың ішінде трансфекциялайтын организмінде патология тудыратын, яғни инсерциялық мутагенез бен қатерлі өспені индукциялайтын ретровирустар генің (сем. Retroviridae) алып тастау қажет. Вирустық РНҚ клетка ядросына енеді, кейін терапиялық генді экспрессиялайды. Сонымен қатар, осы векторлар адамның бөлінбейтін клеткаларына, мысалы нейрондарға, ДНҚ фрагментін енгізуге жарамайды. Тағы митоздық белсенділігі төмен клеткаларына да гендерді тасымалдауға болмайды (мысалы, тыныс алу жолдарының эпителий клеткаларына);

Сурет 2. Вирустық вектор көмегімен терапиялық генді трансфекцияның сызбанұсқасы
Ескерту. Қажетті гендері бар сусызданған РНҚ-вирустар (ретровирустар) ревертаза гендерімен бірге (сызбанұсқада – 1) клеткаға бағытталған. Клетка рецепторлар көмегімен вирустың қабатын таныған кейін (2), вирус клеткаға РНҚ ендіреді (3). Клеткада РНҚ ревертаза көмегімен ДНҚ ауыстырылады (4) және соматикалық клетканың ядросына енеді (5). Онда қажетті гендер мен кейбір вирустық гендерді тасымалдайтын бөгде ДНҚ синтезделінеді және клетканың өз ДНҚ қиыстырылып интеграцияланады (6). Әрі қарай клетка бөлінген жағдайда жаңартылған геномның көшірмесін жасайды, мРНҚ (7), қажетті терапиялық нәруыздарды (8) түзеді. Репликацияланған вирустық РНҚ капсидпен қапталады (9) және басқа клеткаларды жұқтырады (10), ( moikompas.ru сайтынан).
- вирустың репродукциясына жауапты вирустық нуклеотидтер жүйелігін алып тасталынады. Клетка ядросынан тыс вектор құрамындағы терапиялық геннің уақытша экспрессиясы жүреді. Бұл онкогенділігі жоқ аденовирусты векторлар (Adenoviridae тұқым.) және патогенді емес аденоассоциирленген вирустар (Parvoviridae тұқым.); олардың ретровирустардан айырмашылығы, бөлінбейтін клеткаларға терапиялық гендерді енгізуге көмектеседі;
- вектор ретінде тағы қарапайым герпес вирусы қолданылады (Herpesviridae тұқым.). Аденовирустар секілді, қарапайым герпес вирусты клетканың ішінде репродукциялау қабілетін жою үшін олардың гендік-инженерлік өнделуі жүргізіледі. Организм клеткаларына шағын тропизмі қабілеті жоқ ретро- және аденовирустардан айырмашылығы, герпесвирустар тек нейрондарды жұқтыруға талғамды. Сондықтан осы векторлар нерв жүйесі ауруларының гендік терапиясында қолданысқа ие болды.
Липосомалар – микроскопиялық фосфолипидті везикулалар, бір немесе бірнеше биқабатты мембраналардан құралған, олар химиопрепараттар, нәруыздар, ДНҚ, антимағыналы олигонуклеотидтер және т.б. тасымалдаушы зат ретінде қарастырылады. Әртүрлі қасиеттері бар липосомалар дайындалған. Мысалы, катионды (оң зарядты) липосомалар, теріс зарядты ДНҚ молекуласымен байланысып, ДНҚ-липидті комплекс құрайды – липоплекс. Липоплекстерді дайындау жеңіл, ірі гендік конструкцияларды тасиды, улылығы төмен және иммуногенділігі жоқ; биосыйымды, биологиялық сұйықтармен қатысқанда енгізген ДНҚ молекуласын ферментативті деградациядан қорғайды. Липосомалардың өткізгіштік қабілеті оның липидтер құрамына, олардың көлеміне, инкапсулирленген молекула табиғатына, лиганданың мекеніне және ДНҚ трансфекция әдісіне байланысты. Басқа липосомалардан айырмашылығы, рН-тәуелді липосомалар, олардың құрамына кейбір нәруыздар кіретіндігінен, мысалы, гемагглютинин немесе Сендай вирусының HVI нәруызы, олар қышқыл ортада тұрақтылығынан айырылады. Айта кету керек, осындай типтегі липосомаларда трансфекцияланған ДНҚ эндосомада липидтік қабаттан жылдам айырылып, лизосомалық деградацияға ұшырамай цитоплазмаға түсуі керек. Электростатикалық қарым-қатынаспен ДНҚ ұстап тұратын катионды липидтердің айтарлықтай нәтижелігі жоғары.
Иесі клеткасына экзогенді ДНҚ лиганд-рецепторлы әдіспен енгізу. Осы мақсатта трансферрин немесе гликопротеині бар ДНҚ конъюгаты қолданады, себебі көптеген клеткаларда оларға арнайы рецепторлар бар. Рецепторларымен байланысқан кейін ДНҚ конъюгаттарын клеткалар өзіне сіңіреді. Клеткаға еңген ДНҚ адам геномына интеграциялануы әлсіз болғанымен трансфекцияланған ген өзінің қызметін уақытша орындайды.
ДНҚ конструкцияны физикалық әдіспен ендіру - электропорация (клеткаға жоғары кернеулі электр импульстар әсерінен мембрананың өткізгіштігі жоғарлауы қайта орнына келеді, диаметрі 0,5 нм тесіктер пайда болуы); генді «пистолет» қолдануымен баллистикалық трансфекция әдісі (ДНҚ-конструкцияны ауыр металл бөлшектерімен - диаметрі 1-3 мкм алтын немесе вольфраммен конъюгациялайды; ағзалар мен тіндерді атады, ену тереңдігі - 1 мм жетеді; сур. 3А және 3В); бұлшықетті миоцит-клеткаға ДНҚ микроинъекция технологиясы дайындалды.
Комбинирленген вектор. Лиганда-рецепторлы және вирустық вектордың біріктіріп қолдануы, яғни геннің рецепторларға-тәуелді тасымалы тиімді. Қажетті геннің ДНҚ-жүйелігін трансформацияланған клетканың (мысалы, гепатоцит) мембрана рецепторына туыстығы бар нақты затпен (мысалы, гликопротеин) қосады. Алынған комплекс – терапиялық ген мен гликопротеинді клетка ядросына гендік конструкциясын енуін іске асыратын аденовируспен біріктіреді.
Кенейтү камерасы ДНҚ-вакцина енгізілген кассета Гелиймен толтырылған баллон Ауыстырмалы катридж Ұрғыш Сопло Шаннан корғаушы қақпак Сүзгіш Дыбыс басушы Келтіру сақина Газ шығаратын саңылау

Сурет 3А. «Powderject» компанияның көпреттік генді пистолеті
|
|
Сурет 3В. “Powderject” компанияның бірреттік генді пистолеті (а –сыртқы көрінісі, б – кесіндіде)
Осындай комбинирленген вектор нақты ағзалар мен тіндерге генді тиімді жеткізеді, плазматикалық мембранадан өтіп клетка ішіндегі нақты нысанаға апарады.
Гендерді енгізу тәсілі бойынша
Гендік терапия ex vivo-да нысана-клеткасына гендік материалды тасымалдау жолымен іске асады, организмнен алдын-ала бөліп алған клеткаларды (лимфоциттер, қызыл жілік майынан дін клеткалары, гепатоциттер, астроциттер, фибробласттар және т.б.), келешекте реимплантациялайды. Еx vivo-да генді тасымалдау мақсаты – пациент клеткаларын бөліп алуы және дақылдандыруы, оған бөгде генді ендіру, трансфекцияланған клеткаларды ажыратып алып сол пациентке реинфузиялау. Клиникалық сынақтар бағдарламаларында осы әдіс жиі қолданылады. Гендік терапияның ex vivo-да жетістіктері алынған трансформацияланған клеткаларға организмге трансплантация жасамай сипаттама беруге болады, осы клеткалардың көптеген клондарын тандап алынып қажетті геннің жоғары деңгейдегі экспрессияланатын клонды ажыратуға және организмге зиян келтіретін қауіпті трансформацияланған клондарды алып тастауын жасауға болады.
In vivo-дағы гендік терапия – бұл қажетті мөлшерде терапиялық гені бар рекомбинантты гендік вектордың бірден организмге тура жасалынатын трансгенезі. Гендік конструкцияны in vivo-да енгізу жолдары:
- тінге инъекция жасау арқылы (бүйрек, айырша без, көлденең-жолақ бұлшықеттер және басқа ағзалары; сур. 4);
- трансфекциялайтын ағзаны қоректендіретін қантамырлар ішіне;
- өкпе патологиясында аэрозольмен енгізу;
Генді енгізү Вектор Бұлшықет тіні Синтетикалық ген
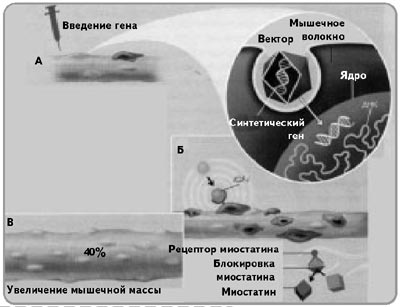
Бұлшықет өсуі Миостатиннің рецепторы Миостатинді блокадалау Миостатин
Сурет 4. Гендік терапия in vivo-да – бұлшықет тініне терапиялық генді инъекциялау
(n-medic.ru сайтынан)
Гендік терапия типі бойынша:
- дефектті ген функциясына коррекция жасау. Дефектті геннің белсенділігін коррекциялау (мутацияда ДНҚ аздаған бөлігі өзгерген) немесе қалыпты түрімен ауыстыру әдістері қазіргі уақытта тек зертханада өнделуде;
- терапиялық генді енгізу. Қазіргі уақытта гендік терапия технологиясының клиникалық зерттеулері клеткада дефектті немесе «ауру» гені сақталған жағдайда организмде терапиялық генді экспрессиялайтын қосымша ген(гендерді) енгізуімен шектелген. Соңғының коррекциясы немесе ауыстырып салу әдістемесі едәуір қиындықтар тудырады. Терапиялық ген организмге жетпей тұрған функцияны қызметті қалпына келтіреді – бұл толықтырушы гендік терапия (augmentative). Айта кету керек, функциональды белсенді дефектті гендер-аналогтары (терапиялық гендер) бар гендік конструкциялармен бірге дефектті геннің экспрессиясын реттейтін ДНҚ жүйелер болған жөн.
– «ауру» геннің қызметін тежеу (antisence RNA). Инфекцияда, ісіктік трансформацияда және басқа патологияларда геннің қызметі шектен тыс асады, сондықтан оны тежеу қажет. Дефектті геннің мРНҚ репликациясы екі жолмен өтеді немесе РНҚ антисенс терапиясы (РНҚ синтезін қамтамасыз ететін клетка құрылымының мРНҚ деңгейінде ген қызметінің тежелуі, бұл дефекті геннің мРНҚ комплементарлы болып келеді) немесе антимағыналы РНҚ терапиясы (дефектті геннің мРНҚ комплементарлы болып келетін жасанды РНҚ, клеткаға енгізгенде ол мРНҚ байланысуында трансляцияны тежейді. мРНҚ-дағы нуклеотидтер қарама-қайшы орналасуына байланысты осындай жасанды мРНҚ антимағыналы деп атайды). Антисенс РНҚ терапия мен антимағыналы РНҚ терапия негізінен ұқсас келеді және жалпы аталуы бар - antisence RNA. Мысалы, дефектті геннің экспрессиясын басу үшін келесіні істеу қажет: геномнан ДНҚ фрагментін бөліп алып гендік конструкцияға төнкеріп (антимағыналы) салу (сур.5). Осындай жағдайда антимағыналы РНҚ өндіріледі, бірақ ол нысана-геннің мРНҚ байланыса алады. Нәтижесінде транскрипциядан кейінгі гендік сайленсинг жүреді – трансляция тоқталады, нысана-геннің мРНҚ бұзылуынан экспрессиясы бірден тежеледі немесе толығымен тоқтап қалады.
гендік конструкция өсімдік геномындағы пролиндегидрогеназаның гені
антимағыналы РНҚ пролиндегидргеназаның мРНҚ
антимағыналы РНҚ әсерімен байланысты трансляцияның тежелуі, пролиндегидрогеназаның мРНҚ бұзылуы және фермент синтезі тоқталады антимағыналы РНҚ жок болғанда ферменттің калыпты синтезі байкалады

Сурет 5. Транскрипциядан кейінгі деңгейде антимағыналы РНҚ синтезі нысана-генді экспрессиялауы (пролиндегидрогеназа ферменті антисенсті тежейді),
( Э.Файер және К.Мэлоу, 2007)
1.2. ДНҚ – диагностикасы
Кейбір кең таралған обыр түрлеріне тұқымқуалайтын бейімделгіш гендер идентификацияланған, молекулалық деңгейде «науқас» гендер анықталған, олардың сүт безі обырымен, аналық безбен, тоқ ішек, қалқанша безі, көздің торқабықтың (ретинобластома) және бүйректің балалық ұрықтық ісіктеріне байланысы нақты дәлелденген. Мысалы, сүт безі және аналық бездер клеткаларында канцерогенез процесін тудыратын гендер идентификацияланған - BRCA1, BRCA2, ген «Ret». Осындай гендерде мутация пайда болғанда қатерлі ісіктер тағы тоқ ішегінде, аталық безде және қалқанша безінде де дамиды. Сондықтан пациенттер күрделі толық тексерулер өту қажет.
Жиырма жастағы студент шағым айтпайды. Бірақ, оның әжесі мен тәтесі отыз жасқа дейін қалқанша без обырынан қайтыс болған. Анасы да бірнеше операция жасатқан. Осындай трагедиялық тәжірибеден кейін және жоғары білімді болғандықтан анасы жас баласына жаң-жақты толық тексерулерден өтуін сұрады. Қорқыныштары себепсіз болмаған: онда да сол мутацияны анықтаған! Генетиктердің пікірі бойынша, операция жасатуды ұзаққа созуға болмайтындығы, өліммен пара-пар деп тұжырым берген. Ал хирургтер генетиктердің ұсынысын қолдамады. Яғни, дені сау адамнан аурудың клиникалық белгілері болмай қалқанша безді алып тастау қалай болады? Қандай хирург операцияға барады? Бірақ генетиктер өз пікірлерінде тұрды. Операциядан кейін гистология алып тастаған безде қатерлі клеткалар бар екенін дәлелдеді. Айта кету керек, УДЗ, биопсия, және басқа да күрделі зерттеулер ешқандай зақымдар көрсетпеген. Мутация «Ret» генімен байланысты болған.
Қазіргі уақытта ДНҚ-диагностика традициялық цитологиялық зерттеулерді итеріп тастады және онкологиялық тексерулердің барлық кезеңдерінде қолданылады – онкологиялық науқастардың профилактикасында, диагностикасында және емдеуінде. Ісіктік синдромдардың ДНҚ-диагностикасы үшін бірнеше гендердің нуклеотидтер жүйелерінің толық секвенирленуі жүргізілуі қажет. Осындай зерттеулер қазіргі уақытта өте қымбат тұрады. Бірақ, кейбір жағдайларда аса экономды ұстанымдар белгілі. Мысалы, сүт безі обыры дамуының жоғары қуіптілігі BRCA1 және BRCA2 гендердегі дефектілерге тәуелді. Олар жиі геннің бір бөлігінде орналасады, сондықтан осындай мутацияны анықтау үшін қаумақты секвенирлену қажет емес. Тоқ ішектің тұқымқуалайтын полипозды емес обырында зақымданған геннің (MSH2, MLH1) микросателлитті тұрақсыздығын қарапайым тестімен анықтауға болады. Осындай жағдайда тектік анализ жасаған маңызды. Тоқ ішектің тұқымқуалайтын көптік аденоматозды полипін олардың маркерлік нәруыздарын анықтауымен идентификацияланады, секвенирленуден едәуір оңай.
Кейбір онкологиялық аурулардың молекулалық диагностикасында клондауға бағытталған тесттер маңызды. Клондауға бағытталған тесттердің негізіне өспелер клеткалары бір көзден басталғандықтан, оларға бірдей гендік сипаттама тән болуы алынады. Мысалы, лимфома диагностикасы негізіне клондау тесті алынады. Сүт безінің (емшектің) шынайы билатеральды обыры идентификациясына басқа әдіс қолданылады – қос ДНҚ сынақтарын аллельді типтерлеу және т.б.
Көптеген ДНҚ-тесттерді күрделі ұзақты процедуралар қатарына жатқызады. Тап осылай шектеусіз санда нуклеин қышқылдарын көбейтіп алуға бағытталған полимеразалық тізбекті реакцияны айтуға болады (сур.6). ПТР-әдісімен ДНҚ көбейту үшін ДНҚ-полимераза ферменттері қолданылады, яғни клеткада бөлек нуклеотидтерден ДНҚ комплементарлы тізбектерін синтездейтін ферменттер. Осы мақсатта ДНҚ бар пробиркаға активтенген мононуклеотидтер қоспасын қосады, оның құрамында ДНҚ-полимераза ферменті және көбейген ДНҚ шетіне комплементарлы болып келетін олигонуклеотидтер - праймерлер бар. Қыздырғанда ДНҚ тізбектері ыдырайды. Кейін салқындатқанда, оларға праймерлер қосып, спиральды құрылымдардың қысқа фрагменттері пайда болады. Фермент праймерлерге нуклеотидтерді біріктіріп тізбек құрайды, олар көбейген ДНҚ тізбекке комплементарлы болып келеді. Келешекте цикл көп рет қайталанып отырады. Нақты уақыттағы режимде жүргізілетін ПТР, нуклеин қышқылдарының капиллярлы электрофорезі, масс-спектрометриясы онкологияда қолдануы перспективті.
Алғашқы ДНҚ

Сурет 6. Полимеразалық тізбекті реакция әдісі (ПТР), шектеусіз санда нуклеин қышқылдарын «көбейту» қабілеті биологияда шынайы революция жасады. Әдістің мақсаты қарапайым: қыздырғанда ДНҚ спиралі ажыратылады, ал кейін арнайы фермент көмегімен әр тізбекке олардың комплементарлығын тізеді. Нәтижесінде бір екі тізбекті ДНҚ-дан екеуі пайда болады. Екеуден – төртеу және әрі қарай көшірмелер көбейе береді. Бұл процесті шектеусіз қайталай беруге болады!

