
- •Лекция 9. Строение атома
- •§ 1 Атом. Химический элемент. Простое и сложное вещества .
- •§ 2. Как обнаружить атом?
- •§ 3. Электронное строение атома . Модель Бора.
- •§ 4. Корпускулярно- волновой дуализм электронов.
- •§ 5. Квантово-механическая модель электронного строения атомов.
- •§ 6. Электронная конфигурация атомов.
- •§ 7 Периодический закон и периодическая система элементов.
- •§ 8 Основные характеристические свойства атомов.
- •§ 8.1.Атомные и ионные радиусы.
- •§8.2. Энергии ионизации.
- •§8.3 Сродство к электрону.
- •§ 8.4 . Электроотрицательность
§ 6. Электронная конфигурация атомов.
Распределение энергий атомных орбиталей представлено на рис. 7. Чем ближе к ядру расположена орбиталь , тем более отрицательно её значение. По мере возрастания главного квантового числа разница в энергиях уровней уменьшается
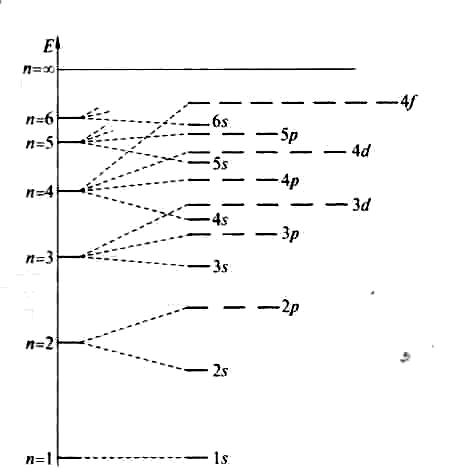
Рис. 7 . Распределение энергий атомных орбиталей. n –главное квантовое число.
Электронная конфигурация- это распределение электронов по энергетическим уровням орбиталей. Для построения электронной конфигурации атомов используются следующие правила заполнения орбиталей электронами.
1. Правило наименьшей энергии. В первую очередь заполняются с наименьшей энергией, т.е. выполняется последовательность: 1s < 2s <2p <3s<3p < 4s……
2. Принцип Паули. На одной орбитали может находиться не более двух электронов с разными значениями спинового квантового числа.
3.. Правило Хунда. В пределах одного подуровня электроны располагаются так, чтобы максимальный спин был максимальным. Это значит, что сначала на каждой орбитали данного подуровня электроны размещаются по одному. Когда же все орбитали окажутся занятыми наполовину, на них может появиться второй электрон.
Примеры электронных конфигураций атомов приведены на рис 8
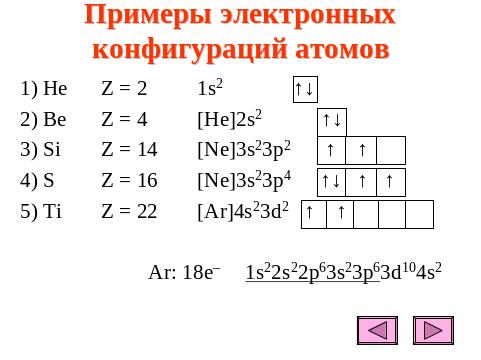
Рис. 8. Примеры электронных конфигураций атомов.
Для описания электронной конфигурации атомов и построения молекулярных орбиталей важное значение имеет характер изменения взаимного расположения энергий 2s- и 2р- орбиталей (Рис9).

Рис. 9. Изменение энергии 1s-, 2s- и 2p-орбиталей у атомов
2-го периода Периодической системы.
Главная особенность этого изменения в том, что от Li к Ne увеличивается разность энергии 2s- и 2p-орбиталей. Почему?- Потому, что с ростом заряда ядра 2s-орбитали , во-первых, приближаются по энергии к ядру и во-вторых, начинают сильнее экранировать 2р- орбитали., которые поэтому удаляются от ядра и энергия их повышается. Таким образом в рассматриваемом ряду от Li к Ne увеличивается разность энергии 2s- и 2p-орбиталей.
§ 7 Периодический закон и периодическая система элементов.
Естественный ряд химических элементов 1Н, 2Не, 3Li……108Hs, 109Mt образует систему с периодическим изменением электронной конфигурации атомов и свойств химических элементов.
Такую периодичность Д.И.Менделеев сформулировал в виде периодического закона, который в современной виде записывается в виде : Свойства простых веществ, а также формы и свойства химических соединений элементов находятся в периодической зависимости от заряда ядра. Периодичность свойств основана на сходстве конфигураций внешних электронных орбиталей атомов и определяется периодичностью их повторения . Например, галогены F, Cl, Dr, I, Ft имеют на внешнем электронном уровне одинаковое число электронов ( ns2 np5 ) и сходные химические свойства.
Графическим представлением периодического закона является периодическая система элементов. Элементы расположены в таблице в порядке увеличения заряда ядра. Вертикальные ряды называются группами, а горизонтальные- периодами. По типу валентных орбиталей элементы делятся на блоки: s- блок объединяет элементы с электронной конфигурацией ns1 и ns2 , у элементов р- блока происходит заполнение р – подуровня, d- и f –блоки объединяют элементы с заполняющимися (n – 1)d- (n- 2) f- орбиталями соответственно. f-элементы выделяют в отдельные семейства лантаноидов (4 f) и актиноидов (5f ) .
Периоды объединяют элементы, в атомах которых заполняются одинаковые электронные уровни. Номер же периода совпадает с главным квантовым числом
( n ). Каждый период завершается элементом с завершенной электронной конфигурацией ns2 np6. Далее происходит заполнение ( n +1)) уровня. Различие в последовательности заполнения внешних и более близких к ядру уровней объясняет причину различной длины периодов. 1-ый период содержит два элемента, 2-ой и 3-ий – по восемь элементов каждый, 4-ый и 5-ый по 18, а 6-ой -32 элемента.
Группы объединяют элементы, атомы которых имеют одинаковое число электронов на внешнем уровне. Согласно системе , рекомендованной ИЮПАК*, Периодическая таблица имеет 18 периодов, которые обозначаются арабскими цифрами от 1 до 18. В старом коротком варианте имеется 8 периодов, которые обозначаются римскими цифрами от I до VIII.
