
- •Лекция 9. Строение атома
- •§ 1 Атом. Химический элемент. Простое и сложное вещества .
- •§ 2. Как обнаружить атом?
- •§ 3. Электронное строение атома . Модель Бора.
- •§ 4. Корпускулярно- волновой дуализм электронов.
- •§ 5. Квантово-механическая модель электронного строения атомов.
- •§ 6. Электронная конфигурация атомов.
- •§ 7 Периодический закон и периодическая система элементов.
- •§ 8 Основные характеристические свойства атомов.
- •§ 8.1.Атомные и ионные радиусы.
- •§8.2. Энергии ионизации.
- •§8.3 Сродство к электрону.
- •§ 8.4 . Электроотрицательность
Лекция 9. Строение атома
§ 1 Атом. Химический элемент. Простое и сложное вещества .
Атом -химически неделимая, электронейтральная частица, которая состоит из нуклонов* – протонов ( 11р), нейтронов (01 n) и электронов е- . Это понятие имеет важное значение для описания химических превращений. ______________________________________________________________
_*) Строго говоря, нуклоны не являются неделимыми, а состоят из кварков
Отметим, что химический элемент- это совокупность атомов с определенным одинаковым зарядом ядра. Простое вещество- то вещество, которое состоит из атомов одного и того же элемента. Сложное вещество состоит из атомов разных элементов.

§ 2. Как обнаружить атом?
Существуют косвенные и прямые методы свидетельства существования атома. К косвенным методам относятся :
а) процесс электролиза,
б) явление фотоэффекта,
в) электролитическая диссоциация
г) естественная радиоактивность.
К
прямым методам относятся методы
сканирующей зондовой микроскопии -
туннельной (СТМ) и атомно- силовой
(АСМ)атомной силовой, а также электронной
микроскопии. На фотография поверхности
графита (Рис 1), полученной с помощьюатомной
силовой микроскопии (АСМ), отчетливо
видны.

Рис. 1 Фотография атомной поверхноcти графита.
______________________________________________________________
_*) Строго говоря, нуклоны не являются неделимыми, а состоят из кварков
атомы графита, образующие регулярную структуру.
Протоны и нейтроны в атоме формируют положительно заряженное ядро, в котором практически сосредоточена вся масса атома. Заряд ядра (Z) определяется числом протонов. Электроны в атоме расположены вокруг ядра и
занимают пространство, которое существенно превышает обьем ядра: диаметр
ядра составляет около 10-12 см, диаметр атома – 10-8 см.С точки зрения химии заряд ядра- основная характеристика атома, так как он определяет число электронов. Химические же свойства вещества связаны с перераспределением электронной плотности и таким образом, зависят от электронной конфигурации атомов.
§ 3. Электронное строение атома . Модель Бора.
Электронное строение атома определяется, во-первых, энергией электронов и , во-вторых, тем как они распределены в пространстве.
Если пропустить свет от газоразрядной лампы сквозь щель и образовавшийся луч направить на призму, а затем на экран, то на нем образуется система полос, или линейчатый спектр испускания ( Рис 2 ).

Рис2. Линейчатый спектр испускания. 1- пучок лучей, 2- щели, 4- экран, 5- линейчатый спектр, газоразрядная лампа.
Этот факт связан с квантованием (порционностью) энергии электронов. Первая квантовая модель электронного строения атомов создана Нильсом Бором. Её основные положения следующие:
Отрицательно заряженные электроны двигаются вокруг положительно заряженного ядра по орбитам ( Рис 3 ).

Рис 3.Схема орбит. 1- электрон, 2 и 3 орбиты с энергиями Е1 и Е2, 4 - ν частота испускаемого света ν = (Е2 – Е1)/ h
 Каждая
орбита характеризуется определенной
энергией Е и её номером т.е. квантовым
числом n
. Орбита с самой низкой энергией
Каждая
орбита характеризуется определенной
энергией Е и её номером т.е. квантовым
числом n
. Орбита с самой низкой энергией
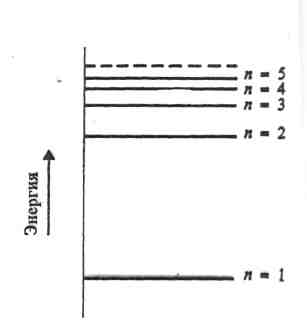
( ближайшая к ядру) характеризуется квантовым числом n = 1. Следующим уровням соответствуют квантовые числа 2, 3 и т.д. (Рис 4)
Рис.4. Уровни энергии для некоторых значений квантового числа п
Штриховая линия соответствует уровню, на котором электрон обладает энергией, достаточной для того, чтобы покинуть атом: происходит ионизация атома
Переходы электронов между орбиталями с энергиями Е1 и Е2 связаны с изменением энергии ∆ Е и обуславливают не непрерывное, а квантовое
( порционное) поглощение или испускание света с частотой (ν) , или длиной волны (λ)
∆ Е = Е2 – Е1 = h ν = hc/ λ ( 1 )
где h- постоянная Планка (6.62 10-34 Дж с), а с – скорость света. Спектр поглощения возникает, когда электроны с низких орбит возбуждаются и переходят на более верхние орбиты. Спектр испускания возникает в обратном случае, если электроны с возбужденных , верхних орбит
« падают» обратно на орбиты с меньшей энергией. Такие электроны отдают энергию, испуская её в виде светового излучения с частотой (ν), определяемой уравнением Планка (1)
