
- •129301, Г. Москва, ул. Касаткина, д. 3, стр. 2
- •Раздел 1. Химические методы анализа....................................................................................6
- •Раздел 2. Физико-химические методы анализа......................................................................24
- •Как оформить работу:
- •О некоторых тонкостях использования химической посуды.
- •Раздел 1. Химические методы анализа. Теоретическое введение.
- •Лабораторная работа №1. Определение содержания витамина с в различных продуктах.
- •Лабораторная работа № 2. Определение содержания восстанавливающих сахаров в пищевых продуктах.
- •Лабораторная работа № 3. Определение содержания антиоксидантов в чае.
- •Раздел 2. Физико-химические методы анализа. Теоретическое введение
- •Лабораторная работа №4 Определение содержания нитрита в пищевых продуктах.
- •Лабораторная работа №5. Определение содержания нитрата в пищевых продуктах.
- •Лабораторная работа №6. Разделение жиров методом тонкослойной хроматографии.
- •2. Липиды и жиры.
- •Список литературы.
Раздел 2. Физико-химические методы анализа. Теоретическое введение
![]()




Лабораторная работа №4 Определение содержания нитрита в пищевых продуктах.
Цель работы – определение содержания нитрита в пищевых продуктах фотометрическим методом.
Теоретическое введение:
1. Введение в оптический анализ.

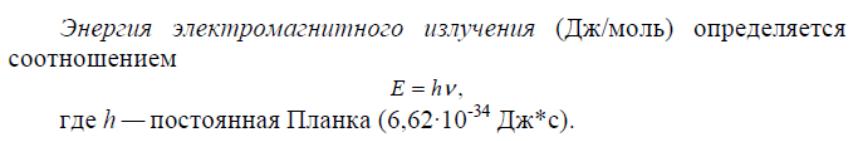
Классификация оптических методов анализа:
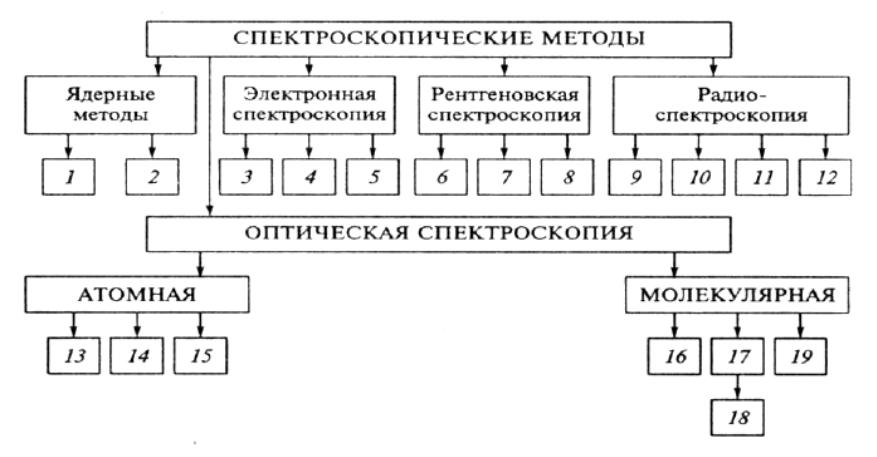

![]()




2. Нитриты.
Азот — это один из самых важнейших химических элементов в жизни растений, т. к. он необходим для синтеза аминокислот, из которых образуются белки. Растение получает азот из почвы в виде минеральных азотных солей (нитратных и аммиачных).
В растениях азот подвергается сложным превращениям. Метаболизм азота в растениях — это сложный процесс, и нитраты занимают в нём промежуточное положение:
HNO3 – HNO2 – (HNO)2 – NH2OH + NH3 |
(нитрат) (нитрит) (гипонитрит) (гидроксиламин) (аммиак)
Нитраты в растениях восстанавливаются до нитритов. В этом процессе участвуют различные металлы (молибден, железо, медь, марганец), и при этом происходит интенсивная трата углеводов, т. к. на восстановление требуется энергия, источником которой являются углеводы. Нитриты могут накапливаться в растениях и этим подавлять их рост. Но основная часть нитритов, подвергаясь дальнейшим превращениям, даёт аммиак (NH3). Аммиак русский учёный Д.М. Прянишников назвал альфой и омегой в питании растений.
В организме человека нитрат также способен восстанавливаться до нитрита за счет деятельности микроорганизмов в кишечнике человека. Однако нитрит может поступать в организм напрямую с пищей, так как используется в виде пищевой добавки. Нитрит натрия (Е 250), так же, как и гуаровая камедь и модифицированный крахмал , указаны на упаковке практически любого товара, который мы покупаем ежедневно. «Все есть яд, и все есть лекарство. Одна только доза делает вещество или ядом, или лекарством», - это утверждение Парацельса более чем актуально для всех искусственных добавок Е . Нитрит натрия обладает рядом полезных свойств, которые делает это вещество незаменимым в пищевой и фармацевтической промышленности. В то же время нитрит натрия – опасный яд, передозировка которого грозит непоправимыми последствиями для организма.
Пищевой нитрит натрия – добавка Е 250, которая используется в качестве фиксатора окраски и консерванта в изделиях из мяса и рыбы.
Нитрит натрия связывает молекулы гемоглобина. Это свойство Е 250 обеспечивает колбасе и другим мясным изделиям приятный розовый цвет, который ассоциируется у нас со свежим качественным мясом. Мясные изделия, изготовленные без нитрита натрия, не будут выглядеть столь привлекательно.
Нитрит натрия – консервант, антибактериальный агент. Е 250 предотвращает рост возбудителей ботулизма. Использование нитрита натрия при производстве продуктов питания предотвращает одну из самых тяжелых пищевых интоксикаций. Е 250 способствует формированию специфического вкуса и аромата мясных и рыбных изделий.
Нитрит натрия – токсичное вещество для млекопитающих. Норма содержания нитрита натрия в готовой продукции – не больше 50 мг на 1000г, для детского питания – не более 30мг на 1кг.
Тем не менее, в медицине нитрит натрия используется для следующих целей: 1. Нитрит натрия обладает сосудорасширяющими, бронхолитическими свойствами, снимает спазмы. 2. Препараты нитрита натрия применяются при стенокардии, при спазмах сосудов головного мозга. 3. Нитрит натрия используется в качестве антидота при отравлении цианидами.
Главная опасность использования нитрита натрия в пищевых продуктах – возможность образования нитрозаминов, вызывающих онкологические заболевания. Нитрозамины образуются в продуктах с содержанием Е 250 при их нагревании, например, в жареном беконе. По мнению некоторых ученых, употребление подобных продуктов вызывает рак кишечника и другие формы онкологических заболеваний. Предотвратить канцерогенный эффект помогает витамин С. Продукты, в которых сочетаются Е 250 и аскорбиновая кислота, по мнению специалистов, являются безопасными. Кроме того, употребление мясных и рыбных изделий вместе с большим количеством овощей, содержащих витамин С, также предотвращает канцерогенный эффект нитрозаминов.
Передозировка нитрита натрия настолько опасна для здоровья, что может привести к летальному исходу. Высокая концентрация нитритов приводит к кислородному голоданию организма. Признаки отравления нитритом натрия: посинение кожных покровов, одышка, учащенное сердцебиение, потеря сознания. Для предотвращения передозировки нитрита натрия нужно покупать колбасные изделия, мясные и рыбные копчености, изготовленные по нормативным документам. Не стоит рисковать, приобретая продукцию подпольных производителей в сомнительных местах продажи.
Наибольшая доза нитритов поступает в организм не с продуктами питания, при производстве которых использовалась Е 250, а с овощами и фруктами. Формирование нитрозаминов в мясных и рыбных изделиях нейтрализуется витамином С. Продукция, в составе которой есть нитрит натрия, изготовленная в соответствии с санитарными нормами, безопасна для взрослого здорового человека. Но для детского и диетического питания отдавать предпочтение следует все-таки натуральному мясу и рыбе.
Приборы и реактивы:
Фрукты/овощи.
Реактив Грисса 1: 0,6% раствор сульфаниловой кислоты в 25% уксусной кислоте.
Реактив Грисса 2: 0,6% раствор N-нафтиламина в 25% уксусной кислоте.
Пробирки
Пипетки
Фотоколориметрметр «Экотест-2020»
Ход работы:
Кусочек продукта взвесить, растереть в пюре в ступке при помощи пестика; получившееся пюре перенести в колбу и залить 100 мл дистиллированной воды. Добавить несколько капель 0,1Н НCl, хорошенько взболтать.
Отобрать в пробирку 1 мл р-ра, полученного в п.1. Добавить 1 мл. реактива Грисса 1. Подождать 5 мин.Добавить в ту же пробирку 1 мл реактива Грисса 2.
Перелить раствор из пробирки в кювету, установить ее в прибор и измерить оптическую плотность раствора на длине волны 525 нм. Зафиксировать значение.
Повторить п. 1-3 для всех продуктов.
Результаты:
Результаты следует представить в виде таблицы:
№ |
Продукт |
D |
m продукта, г. |
С нитрита, мг/г |
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
Уравнение калибровочной прямой: (выясн. у преподавателя)
Калибровочная прямая имеет вид D=kC, где D – оптическая плотность, С – концентрация нитрита в растворе, мг/л. Для того, чтобы пересчитать на концентацию нитрита в продукте, требуется значение концентрации умножить на 0,1 (объем раствора из п.1) и разделить на массу продукта. Конечная формула имеет вид:
С=[D*0,1]/[k*mпрод.], мг/г.
