
- •129301, Г. Москва, ул. Касаткина, д. 3, стр. 2
- •Раздел 1. Химические методы анализа....................................................................................6
- •Раздел 2. Физико-химические методы анализа......................................................................24
- •Как оформить работу:
- •О некоторых тонкостях использования химической посуды.
- •Раздел 1. Химические методы анализа. Теоретическое введение.
- •Лабораторная работа №1. Определение содержания витамина с в различных продуктах.
- •Лабораторная работа № 2. Определение содержания восстанавливающих сахаров в пищевых продуктах.
- •Лабораторная работа № 3. Определение содержания антиоксидантов в чае.
- •Раздел 2. Физико-химические методы анализа. Теоретическое введение
- •Лабораторная работа №4 Определение содержания нитрита в пищевых продуктах.
- •Лабораторная работа №5. Определение содержания нитрата в пищевых продуктах.
- •Лабораторная работа №6. Разделение жиров методом тонкослойной хроматографии.
- •2. Липиды и жиры.
- •Список литературы.
Лабораторная работа № 3. Определение содержания антиоксидантов в чае.
Цель работы: определить содержание антиоксидантов в чае в пересчете на рутин.
Теоретическое введение:
Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы.
К активным формам кислорода относят:
ОН• - гидроксильный радикал;
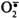 -
супероксидный анион;
-
супероксидный анион;Н2О2 - пероксид водорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий.
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении.
Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов (ПОЛ). Одним из компонентов этой системы являются антиоксиданты, точнее витамины и витаминоподбные вещества, обладающие антиоксидантым действием. Рассмотрим некоторые из них.
Витамин Е (α-токоферол) - наиболее распространённый антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен.
Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO•), восстанавливая его до гидропероксида (ROOH) и таким образом останавливает развитие ПОЛ (рис. 8-56).
Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму -- токоферолхинон.
Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода - , Н2О2, ОН• и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантаьш действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, кароти-ноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты - помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток. Также к антиоксидантам относятся витамины Р и Q.

Суть перманганатометрии заключается в определении концентрации веществ-восстановителей путем добавления перманганата калия в кислой среде.

Приборы и реактивы:
Разл. виды чая
KMnO4 0,005 моль/л.
H2SO4 разв.
Плитка
Колбы термостойкие
Пипетки
Пробирки
Ход работы:
Положить в колбу пакетик или всыпать 1 ч.л. чая. Залить 100 мл горячей дистиллированной воды. Подождать 5 мин.
Отобрать в колбу 1 мл р-ра, полученного в п.1. Добавить 5 мл. H2SO4 разв. Поставить на плитку, нагреть до кипения.
В кипящий раствор добавлять ПО КАПЛЯМ (!) раствор KMnO4, до тех пор, пока раствор в колбе не сохранит розовую окраску в течении 30 сек. Зафиксировать объем добавленного раствора.
Повторить п. 1-3 для всех продуктов.
Результаты:
Результаты следует представить в виде таблицы:
№ |
Продукт |
V КmnO4, мл. |
С рутина, мкг/л |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
Известно, что 1 мл 0,1Н KMnO4 cоответсвует 6,4 мкг рутина.Поэтому, расчет концентрации антиоксидантов проводится по следующей формуле:
C=[6,4*VKMnO4 ]/[Vал.*Vр-ра.*10], где
VKMnO4. – объем раствора KMnO4, ушедший на титрование.
Vал. – объем раствора, взятый на анализ (1 мл, см. ход работы)
Vр-ра. – объем воды, который был добавлен к размятому продукту (100 мл=0,1 л, см. ход работы)
10 – коэффициент разведения р-ра КMnO4
Подставляя имеющиеся цифры в формулу получаем:
C=6,4*VKMnO4 , мг/л.
