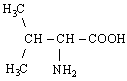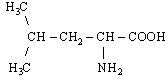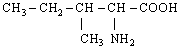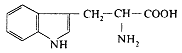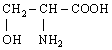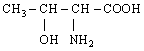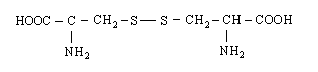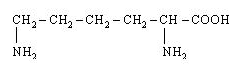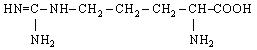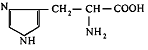- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
2. 2. Амінокислоти
Амінокислоти є похідними карбонових кислот, у яких один з гідрогенів карбогенового ланцюга заміщений на аміногрупу. В залежності від положення - NH2 групи бувають -, -, - і т.п. амінокислоти. У природі зустрічається близько 300 амінокислот, їх можна умовно розділити на дві групи:
1) вільні амінокислоти (непротеїногенні), що не беруть участь в утворенні білків;
2) протеїногенні, ковалентно зв'язані одна з одною у складі пептидів і білків.
Непротеїногенні амінокислоти більш різноманітні в порівнянні з протеїногенними.
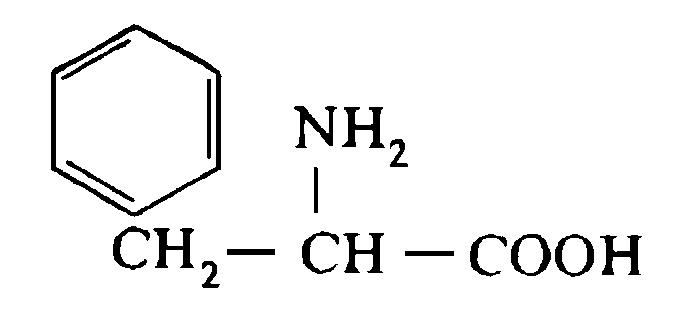
До складу білків входять 20 -амінокислот, у яких аміногрупа -NH2 і карбоксильна група -СООН приєднані до того ж самого -карбогенового атома. Загальна структурна формула -амінокислот може бути представлена в наступному виді:
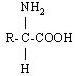
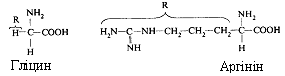
- Амінокислоти відрізняються одна від одної структурою і складом групи R (бічний ланцюг), що може являти собою атом гідрогену, як у гліцині, або більш складне угруповання, як наприклад, гуанідинова група в аргініні.
Амінокислоти класифікуються відповідно до хімічної будови на ациклічні (аліфатичні), ароматичні, гетероциклічні; за кількістю в молекулі амінних і карбоксильних груп - на моноаміномонокарбонові, диаміномонокарбонові, моноамінодикарбонові, диамінодикарбонові.
За сучасною раціональною класифікацією, заснованою на полярності радикалів, виділяють 4 класи амінокислот: 1) неполярні або гідрофобні; 2) полярні (гідрофільні) незаряджені; 3) негативно заряджені; 4) позитивно заряджені при фізіологічних значеннях рН (при рН 6,0 - 7,0).
У таблиці 2.1. представлена класифікація протеїногенних амінокислот. У ній історичні і раціональні найменування, структурна формула і скорочені позначення амінокислот, прийняті у вітчизняній і іноземній літературі.
За біологічним значенням (харчовою цінністю) амінокислоти поділяються на замінні і незамінні. Незамінні амінокислоти не можуть синтезуватися організмом з інших сполук. Людина одержує їх тільки з їжею. Таких амінокислот вісім: з аліфатичних незаміщених - валін, лейцин, ізолейцин; з аліфатичних заміщених - треонін, лізин, метіонін; з ароматичних - фенілаланін; з гетероциклічних - триптофан. Дві амінокислоти - аргінін і гістидин незамінні для дитячого організму, у дорослих же вони частково синтезуються, але в недостатній кількості.
Вищі рослини можуть містити всі необхідні для білкового синтезу амінокислоти. В організмі людини синтезується тільки 10 з 20 амінокислот, що найбільше часто зустрічаються в білках, тому вони відносяться до замінних амінокислот.
У білках є і модифіковані амінокислоти. Хімічна модифікація звичайно відбувається вже після того, як вихідна амінокислота включається до складу білка. Один із прикладів важливої модифікації - окиснювання двох-SH груп цистеїнових залишків з утворенням амінокислоти цистін, що містить дисульфідний зв'язок.
Таблиця 2.1.
Класифікація протеїногенних амінокислот
Назва |
Структура |
Скорочена назва |
||
I. Неполярні або гідрофобні амінокислоти |
||||
l. L-Аланін (α –амінопропіонова кислота) |
|
Ала (Ala) |
||
2. L-Валін (α – аміноізовалеріанова кислота) |
|
Вал (Val) |
||
3. L-Лейцин (α – аміноізокапронова кислота) |
|
Лей (Leu) |
||
4. L-Ізолейцин (α-аміно-β-метилвалеріанова кислота) |
|
Иле (Ile) |
||
5. L-Триптофан (α-аміно-β-індолілпропіонова кислота) |
|
Три (Try) |
||
6. L-Пролін (пірролідин-α-карбонова кислота) |
|
Про (Pro) |
||
7. L-Фенілаланін (α-аміно-β-фенілпропіонова кислота) |
|
Фен (Phe) |
||
8. L-Метіонін (α-амино-γ-метилтіомасляна кислота) |
|
Мет (Met) |
||
II. Полярні (гідрофільні) незаряджені амінокислоти |
||||
9. Гліцин (амінооцтова кислота) |
|
Гли (Gly) |
||
10. L-Серин (α-аміно-β-оксипропіонова кислота) |
|
Сер (Ser) |
||
11. L-Треонін (α-аміно-β-окси-масляна кислота) |
|
Тре (Thr) |
||
12. L-Цистеїн (α-аміно-β-тіопропіонова кислота) |
|
Цис (Cys) |
||
13. Цистин |
|
Цит (Cyt) |
||
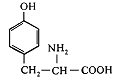
14. L-Тирозин (α-аміно-β-параоксифенілпропіонова кислота) |
|
Тир (Туr) |
||
15. L-Аспарагін (амід аспарагінової кислоти) |
|
Асн (Asn) |
||
16. L-Глутамин (амід глутамінової кислоти) |
|
Глн (Gln) |
||
III. Негативно заряджені (кислі) амінокислоти |
||||
17. L-Аспарагінова кислота (α-амінобурштинова кислота) |
|
Асп (Asp) |
||
18. L-Глутамінова кислота (α-аміноглутарова кислота) |
|
Глу (Glu) |
||
IV. Позитивно заряджені (основні) амінокислоти |
||||
19. L-Лізин (α, ε-диамінокапронова кислота) |
|
Лиз (Lys) |
||
20. L-Аргінін (α-аміно-β-гуанідинвалеріанова кислота) |
|
Арг (Arg) |
||
21. L-Гістидин (α-аміно-β-імідазолілпропіонова кислота) |
|
Гис (His) |
||