- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
Утворення сечової кислоти
Пуринові основи в тканинах піддаються дезамінуванню під впливом дезаміназ. У результаті з аденіну і гуаніну через ряд проміжних етапів утворюється сечова кислота, при дезамінуванні аденін перетворюється спочатку в гіпоксантин.
Потім гіпоксантин окисляється в ксантин, який у присутності води за допомогою ферменту ксантиноксидази окисляється до сечової кислоти.
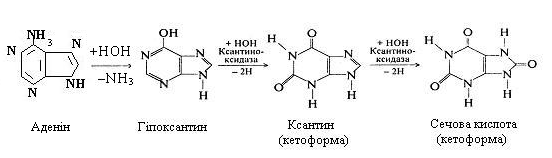
При дезамінуванні гуаніну утворення сечової кислоти відбувається ще швидше, ніж при дезамінуванні аденіну.
При відщіпленні аміногрупи від гуаніну відразу утвориться ксантин, а потім сечова кислота. Сечова кислота є кінцевим продуктом обміну пуринових основ в організмі людини.
При надмірному споживанні м'ясних продуктів і посиленому біосинтезі пуринових основ, у тому числі за рахунок амінокислот (аспарагінової, глутамінової, гліцину), а також при ускладненому виведенні сечової кислоти з організму розвивається захворювання - подагра. У хворих збільшується концентрація сечової кислоти, у 10-15 разів перевищуюча норму. Важко розчинена сечова кислота погано виводиться із сечею і відкладається у виді солей в області дрібних суглобів і під шкірою. Навколо вузликів виникає запальна ділянка, що приводить до порушення функції суглобів, болю.
Піримідинові основи не переходять у пуринові, тому вони не можуть бути джерелом сечової кислоти. На відміну від пуринових дезаміновані піримідинові основи відновлюються, потім розпадаються до оксиду карбогену і аміаку.
NH3 і СО2, що вивільняються в результаті цих реакцій, використовуються для біосинтезу сечовини, азотистих основ, у процесах декарбоксилювання та інших реакціях.
10.8. Біосинтез білка
Біосинтез білка протікає у всіх клітках живого організму і забезпечує відновлення білкового складу, процеси обміну речовин і їхню регуляцію, а також ріст і диференціювання органів і тканин. Білки синтезуються в тканинах з вільних амінокислот при участі нуклеїнових кислот. Вони знаходяться в процесі постійного розщеплення і синтезу. Швидше усіх відновлюються білки плазми крові, печінки, нирок, слизової оболонки тонкої кишки і підшлункової залози. Протягом дев'яти діб обновляється близько 50 % білків печінки. Повільніше цей процес відбувається в м'язах (кожні 120 днів), шкірі й особливо нервовій системі.
У середньому усі білки обновлюються в організмі приблизно за 135-155 діб. За добу в людини синтезується в середньому 1,3 г білку на 1 кг маси тіла, що при середній масі 70 кг складає близько 90 г. Отже, для забезпечення процесу біосинтезу білків необхідно достатнє надходження харчових речовин.
Процес біосинтезу білка протікає зі споживанням енергії, акумульованої у виді АТФ. При цьому забезпечується утворення визначених білків строго специфічної структури, що закодована в ДНК.
Процес синтезу білка можна розділити на три основних етапи. На першому етапі, що зветься транскрипція (від лат. transcrіptіo - зчитування), відбувається синтез молекул М-РНК на ДНК, після чого М-РНК надходять до рибосом. Таким способом відбувається передача інформації про будову синтезованого білка на рибосоми - місце їхнього безпосереднього утворення. Другий етап - рекогніція (від лат. recognіtіon - впізнавання) - це з'єднання амінокислот, необхідних для синтезу поліпептидних ланцюгів, зі специфічними Т-РНК і доставка їх у такому виді в рибосоми. Третій етап - трансляція (від лат. translatіon - переклад) складається в перекладі нуклеотидної послідовності М-РНК в амінокислотну послідовність поліпептидного ланцюга в процесі синтезу білка на рибосомі.
Репродукція білків у всіх організмів відбувається за принципом матричного синтезу за участю нуклеїнових кислот. Під матричним синтезом мається на увазі процес відтворення білків у точній відповідності з програмою. Носієм і хоронителем генетичної інформації є ДНК. Саме в послідовності нуклеотидів ДНК запрограмована інформація, тобто складена матриця, відповідно до якої синтезується визначений білок.
Рисунок 3.4. Біосинтез М-РНК |
Процес синтезу М-РНК починається з того, що молекула ДНК, що має подвійну спіраль, розкручується, і на кожній з її ниток будується молекула М-РНК за принципом комплементарності (рис. 3.4.). Напроти кожної азотистої основи ДНК добудовується відповідна азотиста основа М-РНК. У результаті цього молекула матричної РНК точно повторює послідовність азотистих основ ДНК, а отже, генетичну інформацію. Ділянка молекули ДНК, відповідальний за синтез визначеної М-РНК, називається опероном. Він складається з гена-регулятора, що відповідає за контроль синтезу М-РНК; гена-оператора, "куруючого" початок синтезу, і групу структурних генів, що забезпечують синтез М-РНК. Одержавши інформацію, М-РНК відокремлюється від ДНК і з'єднується з рибосомами, які більш |
ніж наполовину складаються з рибосомної РНК (Р-РНК), синтезованої також на спеціальних генах ДНК.
Рибосоми складаються з двох субодиниць, на які вони здатні зворотно дисоціювати при зниженій концентрації Mg2+. Велика і мала субодиниці рибосом містять по одній молекулі РНК із молекулярною масою відповідно 1,7106 і 0,7106 і по декілька десятків молекул білків. З'єднавшись з рибосомами, М-РНК перетворюються в полірибосоми або полісоми, на яких і відбувається синтез поліпептидних ланцюгів, що утворюють первинну структуру білка.
Процесу синтезу білка передує активування амінокислот при взаємодії з АТФ, при цьому утворюються аміноациладенілати і вивільняється пірофосфат. З аміноациладенілату залишок амінокислоти переноситься на Т-РНК, специфічну для кожної амінокислоти, і у виді аміноацил-Т-РНК надходить у рибосоми. Утворення аміноациладенилату і перенос амінокислотного залишку на Т-РНК каталізується тим самим ферментом - аміноациладенілатсинтетазой, строго специфічним для кожної амінокислоти і кожної Т-РНК. Останні мають хрестоподібну конфігурацію, що нагадує лист конюшини, причому нуклеотидний ланцюг утворює двониткову структуру. На одному кінці Т-РНК розташований кодон-триплет, що складається з трьох азотистих основ, до яких приєднується визначений аміноациладенілат. На протилежному кінці молекули мається антикодон, компліментарний кодонові.
Послідовність амінокислот у первинній структурі синтезованого поліпептидного ланцюга забезпечується інформацією, що записана в послідовності нуклеотидів М-РНК, що відбиває відповідну послідовність у ДНК.
Кожна амінокислота кодується визначеними триплетами нуклеотидів М-РНК. Їхня розшифровка дозволила установити нуклеотидний код РНК або амінокислотний код, тобто спосіб, за допомогою якого відбувається трансляція інформації, записаної в послідовності нуклеотидів РНК у первинну структуру білка або послідовність амінокислотних залишків у поліпептидному ланцюзі. З 64 можливих триплетів 61 кодує визначені амінокислоти, тобто ці триплети є "значними".
Деякі триплети не кодують амінокислоти, однак їхня роль полягає в термінації (від лат. termіnatіon - завершення) синтезу зростаючого поліпептидного ланцюжка. Код є уродженим, а це значить, що майже всі амінокислоти кодуються більш ніж одним триплетом нуклеотидів. Так, амінокислоти лейцин, аргінін і серин кодуються шістьма кодонами, метіонін і триптофан мають тільки по одному кодоні, інших 15 амінокислот - від 2 до 4-х.
Процес трансляції здійснюється за допомогою Т-РНК, навантажених амінокислотами. Аміноацил-Т-РНК приєднується своїм комплементарним триплетом (антикодоном) до кодона М-РНК, що розташована у рибосомі. До сусіднього кодона М-РНК прикріплюється інша аміноацил-Т-РНК. Перша Т-РНК при цьому приєднує свій амінокислотний залишок карбоксильним кінцем до аміногрупі другої амінокислоти з утворенням дипептиду, а сама вивільняється і відокремлюється від рибосоми. Далі, у міру просування рибосоми за ланцюзгом М-РНК відбувається з'єднання дипептиду карбоксильним кінцем з аміногрупою третьої амінокислоти з утворенням і вивільненням другої Т-РНК і так доти, поки рибосома не пройде всю ділянку, що кодує даний білок на М-РНК, яка відповідає гену ДНК.
Потім відбувається термінація синтезу білка, і поліпептид, що утворився, звільняється від рибосоми.
За першою рибосомою слідкує друга, третя і т.д., що послідовно розташовані у полісомі. Таким чином, ріст поліпептидного ланцюга відбувається з N-кінця до С-кінця (якщо призупинити синтез білка, наприклад, за допомогою антибіотика пуроміцину, то можна одержати недобудовані поліпептидні ланцюги з незавершеним С-кінцем). Аміноацил-Т-РНК приєднується спочатку до малої рибосомної субчастки, а потім до великої, на якій і відбувається ріст поліпептидного ланцюга.
Компоненти системи біосинтезу білка синтезуються головним чином у клітинному ядрі. На матриці ДНК у процесі транскрипції відбувається синтез усіх типів РНК, що беруть участь у цьому процесі: Р-РНК, М-РНК, Т-РНК. Так, Т-РНК і М-РНК синтезуються у виді дуже великих молекул і ще в клітинному ядрі проходять стадію "дозрівання", у ході якого значна частина молекули М-РНК відщеплюється і піддається розпадові, не виходячи в цитоплазму, а функціонуюча молекула, що є частиною спочатку синтезованої, надходить у цитоплазму до місця білкового синтезу. Перш ніж увійти до складу полісом, М-РНК із моменту синтезу зв'язується з особливими білковими частками - "інформаторами" і у виді рибонуклеопротеїнового комплексу переноситься до рибосом. Рибосоми, мабуть, також "дозрівають" у цитоплазмі, частина білків приєднується до попередників рибосом, що виходять з ядер, вже в цитоплазмі.
Незважаючи на те, що ядро оточене оболонкою, багато речовин (вітаміни, гормони, продукти обміну й ін.) можуть з цитоплазми проникнути усередину ядра і викликати порушення. Подібні зміни лежать в основі уроджених порушень обміну речовин, до яких власне кажучи відносяться всі спадкоємні хвороби. Так, у деяких людей відсутні деякі ферменти, у зв'язку з чим у їхньому організмі не розщеплюються і не засвоюються окремі харчові речовини, наприклад, незбиране прісне молоко при відсутності в кишечнику лактази - ферменту, що розщеплює лактозу (молочний цукор). В основі таких захворювань, як фенілкетонурія, гістидинурія лежить генетично обумовлене ослаблення біосинтезу ферментів, які каталізують реакції окиснювання амінокислот - фенілаланіну, гістидину. У зв'язку з цим підвищується концентрація даних амінокислот у крові і підсилюється виведення їх із сечею. При фенілкетонурії можливе відставання в розумовому розвитку дитини.
Одним з ефективних методів лікування генетично обумовлених порушень амінокислотного обміну, в основі якого лежить порушення синтезу якогось ферменту (ферментопатія), є дієта, що виключає харчові джерела амінокислот або їхніх похідних, що не мають в організмі відповідних ферментів.
Генетичний апарат дуже чуттєвий до -променів, речовин, що забруднюють біосферу, продуктів окиснювання жирів і інших факторів, які здатні привести до його мутації. Внаслідок цього можуть виникнути помилки при зчитуванні коду і тоді будуть синтезуватися не ідентичні, а чужорідні білки.
Велику роль у порушенні генного апарата грають віруси, що викликають різні захворювання: грип, гепатит і т.д. Володіючи своєю ДНК, віруси при впровадженні в клітину можуть нав'язувати свій код і "диктувати" М-РНК неправильний порядок чергування азотистих основ у ДНК. У результаті можливий синтез чужорідного білка.