
- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
Декарбоксилювання амінокислот
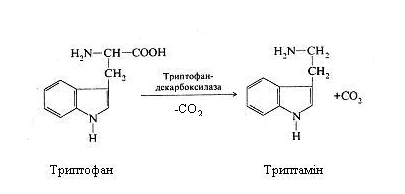
Процес декарбоксилювання каталізується декарбоксилазами, специфічними для кожної амінокислоти, простетичною групою яких служить піридоксальфосфат. Ці ферменти відносяться до класу ліаз. Процес декарбоксилювання, що полягає у відщіпленні від амінокислот СО2 з утворенням амінів, можна показати на наступній схемі:

Механізм реакції декарбоксилювання амінокислот відповідно до загальної теорії піридоксалевого каталізу зводиться до утворення піридоксальфосфат-субстратного комплексу в активному центрі ферменту.
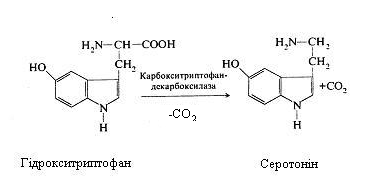
Таким шляхом із триптофану утворюється триптамін, з гідрокситриптофана - серотонін.
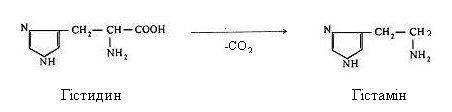
З амінокислоти гістидину утворюється гістамін.
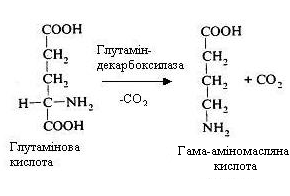
З глутамінової кислоти при декарбоксилюванні утворюється -аміномасляна кислота (ГАМК).
Аміни, утворені з амінокислот, називають біогенними амінами, тому що вони виявляють на організм могутній біологічний ефект.
Біогенні аміни виявляють фізіологічну дію в дуже малих концентраціях. Так, введення в організм гістамину приводить до розширення капілярів і підвищення їхньої проникності, звуження великих судин, скорочення гладких м'язів різних органів і тканин, підвищення секреції соляної кислоти в шлунку. Крім того, гістамін бере участь у передачі нервового порушення.
Серотонін сприяє підвищенню кров'яного тиску і звуженню бронхів; його малі дози придушують активність центральної нервової системи, у великих дозах ця речовина робить стимулюючу дію. У різних тканинах організму великі кількості гістаміну і серотоніну знаходяться в зв'язаній, неактивній формі. Біологічну дію вони виявляють тільки у вільній формі.
Гама-аміномасляна кислота (ГАМК) накопичується в мозковій тканині і являє собою нейрогуморальний інгібітор-медіатор гальмування центральної нервової системи.
Великі концентрації цих сполук можуть являти загрозу для нормального функціонування організму. Однак у тваринних тканинах мається аміноксидаза, що розщеплює аміни до відповідних альдегідів, що потім перетворюються в жирні кислоти і розпадаються до кінцевих продуктів.
10.5. Процеси знешкодження аміаку
У процесі перетворення амінокислот у тканинах утворюються їхні кінцеві продукти обміну - оксид карбогену, вода й аміак. Вода використовується організмом для забезпечення біохімічних процесів. Оксид карбогену частково виводиться з організму з видихуваним повітрям, інша його частина утилізується в процесах синтезу (наприклад, при синтезі жирних кислот, пуринових основ і т.д. ). Аміак, що утворюється в результаті дезамінування амінокислот, є токсичною речовиною, збільшення його концентрації в крові й інших тканинах робить несприятливу дію, особливо на нервову систему. Токсичність аміаку обумовлена тим, що він сприяє відбудовному амінуванню -кетоглутарової кислоти в мітохондріях. Це приводить до видалення її з циклу Кребса і, як наслідок, до падіння тканинного дихання і надлишкового утворення кетонових тіл з ацетил-КоА.
У процесі еволюції живі організми виробили різні ефективні механізми зі знешкодження токсичної дії аміаку, основними з яких є: утворення амінів глутаміну або аспарагіну, відбудовне амінування, нейтралізація кислот, синтез сечовини.
Синтез глютаміну або аспарагіну має велике значення для організму. Він протікає в місцях безпосереднього утворення аміаку (наприклад, у печінці, мозку), там же знаходиться і фермент, каталізуючий цей процес, глутамінсинтетаза, що відноситься до класу лігаз. Синтез амідів вимагає доставки енергії у виді АТФ, присутності глутамінової або аспарагінової кислот, вільного аміаку і відповідних специфічних ферментів. Реакція синтезу аміду пов’язана з розпадом АТФ.
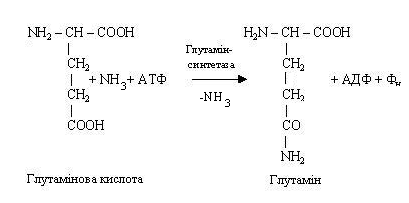
Аналогічно утворюється і аспарагін.
У результаті взаємодії аміаку з глутаміновою і аспарагіновою кислотами відбувається його зв'язування, і в такий спосіб аміак знешкоджується. Зв'язаний аміак може бути використаний як джерело азоту (наприклад, для синтезу пуринових і піримідинових основ, мукополисахаридів). Глутамін і аспарагін не тільки знешкоджують аміак, але і виступають у якості його транспортної форми. У зв'язаному виді аміак доставляється до місця остаточної утилізації - у печінку, де з нього синтезується сечовина.
Синтез сечовини. Одним з найбільш ефективних методів знешкодження аміаку є синтез сечовини. Вперше схема синтезу сечовини була запропонована російським біохіміком М. В. Ненцким, який вважав, що сечовина утворюється з двох молекул аміаку й однієї молекули вугільної кислоти. При цьому у вугільній кислоті гідроксильні групи заміщаються аміаком з утворенням проміжної сполуки карбоновокислого амонію.
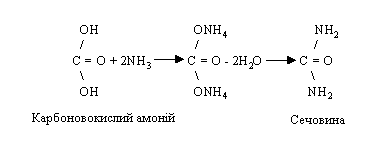
Однак надалі експериментального підтвердження ця теорія не знайшла. Карбоновокислий амоній у печінці практично не виявляється. Крім того, ця речовина не менш отрутна, ніж аміак.
У спеціальних дослідах М. В. Залесского і С. С. Салазкіна на тваринах (лабораторія акад. І. П. Павлова) було встановлено, що якщо венозну кров направити не в печінку, а, минаючи її, у нижню порожню вену, то спостерігаються різке збільшення вмісту аміаку в крові й отруєння. На підставі цих результатів був зроблений висновок, що печінка є органом, у якому відбувається знешкодження аміаку.
У роботах X. А. Кребса й інших дослідників була показана участь у даному процесі речовин і ферментів, каталізуючих реакції синтезу сечовини. Англійський біохімік Х. Кребс вніс великий вклад у сучасну теорію синтезу сечовини. Він встановив, що цей процес носить циклічний характер, і вказав на роль у ньому орнітину. Передумовою для створення теорії синтезу сечовини було виявлення в печінці амінокислоти орнітину і ферменту аргінази, що розщеплює аргінін на орнітин і сечовину. За теорії Кребса, синтез сечовини починається взаємодією орнітину з аміаком і оксидом карбогену. При цьому утворюється цитрулін, що взаємодіє з ще одною молекулою аміаку з виділенням аргініну. Останній гідролізується аргіназою на орнітин і сечовину. Орнітин у цих реакціях виконує роль каталізатора. За відкриття цього циклу X. А. Кребс був визнаний гідним Нобелівської премії.
Замкнутий цикл синтезу сечовини умовно можна розділити на три етапи. На першому і другому етапах відбувається зв'язування двох молекул аміаку в нешкідливу для організму сполуку, на третьому етапі утворюється сечовина.
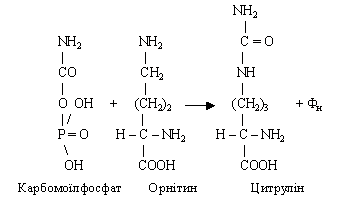
Перший етап. За рахунок енергії АТФ із молекули аміаку й оксиду карбогену синтезується карбомоїлфосфат. Потім відбувається конденсація карбомоїлфосфату з орнітином, у результаті якої синтезується цитрулін. При цьому вивільняється неорганічний фосфат.
Синтез цитруліну забезпечується за рахунок енергії, акумульованої в карбомоїлфосфаті.
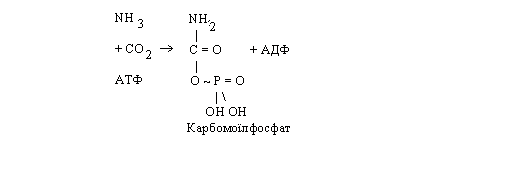
Таким чином, у цитруліні зафіксована одна молекула аміаку.
Другий етап. Відбувається зв'язування ще однієї молекули аміаку в глутамінову кислоту шляхом відбудовного амінування з -кетоглутаровою кислотою. Глутамінова кислота передає зафіксовану молекулу аміаку у виді NH2-групи на щавелевооцтову кислоту, що перетворюється в аспарагінову кислоту (процес переамінування):
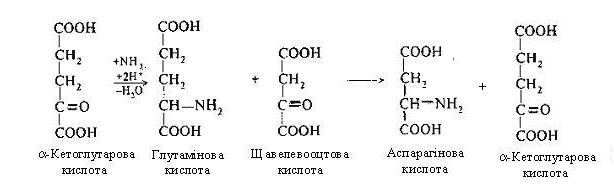
Третій етап. На цьому етапі здійснюється синтез сечовини. Цитрулін, взаємодіючи з аміногрупою аспарагінової кислоти, утворює аргінінобурштинову кислоту (аргінінсукцинат).
У цьому процесі використовується енергія ще однієї молекули АТФ.
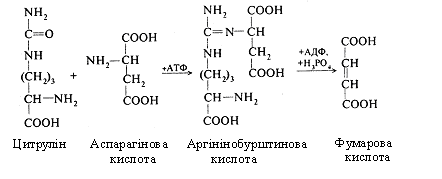
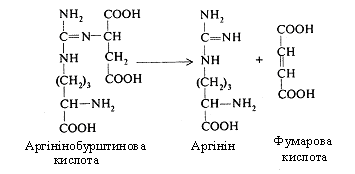
Аргінінобурштинова кислота розщеплюється на аргінін і фумарову кислоту. Фумарова кислота включається у вуглеводний обмін, перетворюючись в яблучну, котра шляхом дегідрування переходить у щавелевоцтову.
Щавелевооцтова кислота може приєднувати до себе аміак і знову перетворюватися в аспарагінову кислоту або, піддаючись декарбоксилюванню, у піровиноградну, а потім у коензим А, що використовується в різних реакціях біосинтезу або окисляється до СО2 і Н2О.
Аргінін, що утворився, під дією аргінази гідролітично розщеплюється на орнітин і сечовину.
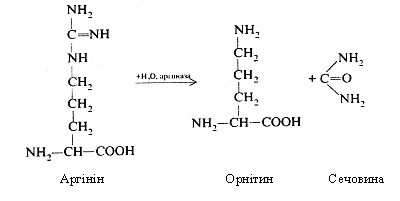
Орнітин, що вивільнився, може знову вступити в реакцію з новою молекулою карбомоїлфосфату і процес повториться.
Підраховано, що в стані азотистої рівноваги організм дорослої людини споживає і відповідно виділяє 15 г азоту; з екскретованого із сечею азоту на долю сечовини приходиться близько 85 %, креатініну - 5, амонійних солей - 3, сечової кислоти - 1, інших його форм - 6.
