
- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
Пірідинозалежні дегідрогенази. До цієї групи каталізаторів відносяться складні ферменти, небілковою частиною яких є НАД і НАДФ (Рис. 7.1.). Останній відрізняється від НАД наявністю ще одної молекули фосфорникотинамідаденіннуклеотидної кислоти.
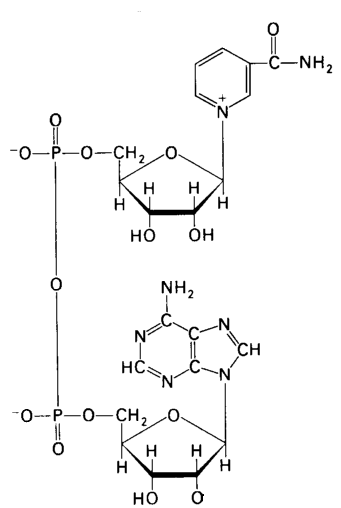
Рис. 7.1. Будова никотинамідаденіндинуклеотиду.
У клітинах НАДзалежні дегідрогенази беруть участь переважно в процесах, зв'язаних з переносом електронів від органічних субстратів до кисню.
НАД містить два залишки азотистих основ, залишки двох рибоз і двох фосфорних кислот. Однією азотистою основою є аденін, другою - амід нікотинової кислоти, якому властива функція вітаміну РР (антипелагричного). З назв азотистих основ і виникла абревіатура НАД.
Акцептором гідрогену в НАД і НАДФ є нікотинамід в окисленій формі. В окисленій формі ця сполука містить у кільці п’ятивалентний нітроген. Після відновлення один атом гідрогену приєднується до карбогену, у результаті чого розривається його подвійний зв'язок із сусіднім атомом. Електрон другого атома гідрогену гасить заряд п’ятивалентного нітрогену, і той перетворюється в тривалентний. Приєднання електрону і зниження валентності є відбудовним процесом. Протон, що залишився, переходить у середовище.
Забираючи атоми водню від субстрату, нікотинамід переходить з окисленої форми у відновлену, і з акцептора водню стає його донатором.
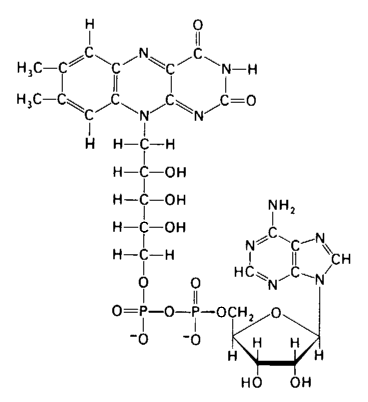
Флавінові ферменти. Наступним акцептором атомів водню виступає група флавінових ферментів, що здійснюють перенос водню (електронів і протонів) від відновленої форми НАД (НАДН2) до цитохромів. До флавінових дегідрогеназ відносяться складні ферменти, небілковою частиною яких є флавінаденіндинуклеотид (ФАД) (Рис. 7.2.). На відміну від нікотинамідаденіндинуклеотиду ФАД містить замість аміду нікотинової кислоти залишок вітаміну В2. Він з'єднаний з похідними рибози (рибітолом), двома залишками фосфорної кислоти, рибозою і аденіном.
Мал. 7.2. Будова флавінаденіндинуклеотиду.
Гетероциклічне ядро вітаміну В2 є ізоалоксазином. Його сполуки називають флавінами, а білки, з'єднані з флавінами - флавопротеїнами. До них відноситься фермент, що є дегідрогеназою, що реагує з НАДН2. Отже, цей флавопротеїн, як правило, не вступає в реакцію безпосередньо з органічними сполуками, що окисляються, тому його називають вторинною дегідрогеназою. Разом з тим, є субстрати, що безпосередньо окисляються флавопротеїнами, вони транспортують відщиплені протони і електрони на оксиген, і в результаті утворюється не вода, а оксид гідрогену. Під впливом ферменту каталази пероксид гідрогену розщеплюється на воду і молекулярний оксиген.
Активною частиною молекули ФАД є ізоалоксазинове кільце рибофлавіну, до атомів нітрогену якого можуть приєднуватися два атоми гідрогену, тобто два електрони і два протони при відповідному внутрімолекулярному перегрупуванні подвійних зв'язків.
Крім ФАД, в окислювально-відновних реакціях бере участь його фосфоролюване похідне - ФАДФ, що містить додатковий залишок фосфорної кислоти, приєднаний до рибози. В усіх цих сполуках вихідними речовинами є вітаміни, що повинні надходити в організм у складі їжі, щоб не порушився фундаментальний процес біологічного окиснювання - основне джерело енергії для процесів життєдіяльності.
Наступним ферментом, який каталізує перенос атомів гідрогену від відновлених флавонуклеотидів, є кофермент Q, або убіхінон, сполука близька до вітаміну К.
Кофермент Q виступає посередником між ФАДН2 і цитохромами. Він являє собою похідне бензохінону з довгим бічним ланцюгом, що складається з 10 ізопреноїдних одиниць.
Відновлена форма флавінових дегідрогеназ у ланцюзі дихальних ферментів передає атоми водню (електрони і протони) до Q. Приєднуючи гідроген, убіхінон з окисленої форми перетворюється у відновлену.
Подальший перенос електронів від відновленої форми убіхінону на оксиген здійснює система цитохромів.
Цитохроми. Цитохроми (від грец. cytos - клітина, chroma - колір) - пігменти, пофарбовані в червоний колір завдяки наявності в їхній молекулі заліза. Встановлено, що в ланцюзі окиснювання ланка цитохромів включається у визначеній послідовності між убіхіноном і оксиген.
цит В → цит С1 → цит С → цит А → цит А3
Причому цитохроми В, С1, А, А3 виконують роль проміжних переносників електронів, а цитохром А3 (цитохромоксидаза) є кінцевим дихальним ферментом, що вступає в безпосередній контакт із оксигеном. Усі цитохроми мають простетичну гемінову групу, ідентичну гему гемоглобіну.
Цитохроми відрізняються друг від друга не тільки простетичними групами. Розходження у властивостях окремих їхніх видів обумовлені будовою білкової частини. Так, у цитохромах В и С гем прикритий "ширмою" з пептидів, що перешкоджає їхній безпосередньої реакції з киснем. У ході каталітичного процесу валентність залізо, що міститься в цитохромах, зворотно міняється (Fe2+ > Fe3+).
Окислена форма цитохромоксидази (Fe3+) приймає електрони від відновленого цитохрому С, переходячи у відновлену форму (Fe2+), що потім знову окисляється в Fe3+ молекулярним оксигеном на етапі цитохрому А3. При цьому утворюється активний оксиген, що приєднує два протони з навколишнього середовища, у результаті чого і виникає молекула води.
У такий спосіб цитохроми завершують транспорт електронів від субстрату, що окисляється, на оксиген.
