
- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
4.4. Загальні уявлення про механізм дії ферментів
В основі дії ферментів як біологічних каталізаторів лежить їхня здатність прискорювати реакції за рахунок зменшення енергії активації субстрату.
Механізм дії ферментів вивчений поки недостатньо. Існуючі в даний час дані дозволяють висловити тільки деякі загальні положення щодо цього питання.
Запуск реакції можна здійснити шляхом подолання сил відштовхування між молекулами, що обумовлено зовнішніми електронами. Ферменти деформують електронні оболонки субстратів, полегшуючи в такий спосіб взаємодію між ними. Енергія, необхідна для того, щоб привести молекули в активний стан, називається енергією активації. Вона використовується для подолання енергетичного бар'єра. Цей процес може здійснити каталізатор. Наприклад, енергія активації, необхідна для розкладання пероксиду водню 2Н2О2 → 2Н2O + О2, без каталізатора складає 75,2 кДж/моль, із застосуванням каталізатора - колоїдної платини - 50,2 кДж/моль, за участю ферменту каталази печінки - 8,3 кДж/моль. Таким чином, роль звичайного каталізатора (і в ще більшому ступені біологічного) полягає в тому, що він знижує енергію активації субстрату.
Існують дві теорії механізму дії ферментів: теорія проміжних сполук і адсорбційна.
Теорія проміжних сполук. Суть процесу - в утворенні фермент-субстратного комплексу (мал. 4.2.). При безпосередній взаємодії субстрату з активним центром ферменту останній певним чином впливає на субстрат, викликаючи перебудову його хімічних зв'язків і тим самим активізуючи його.
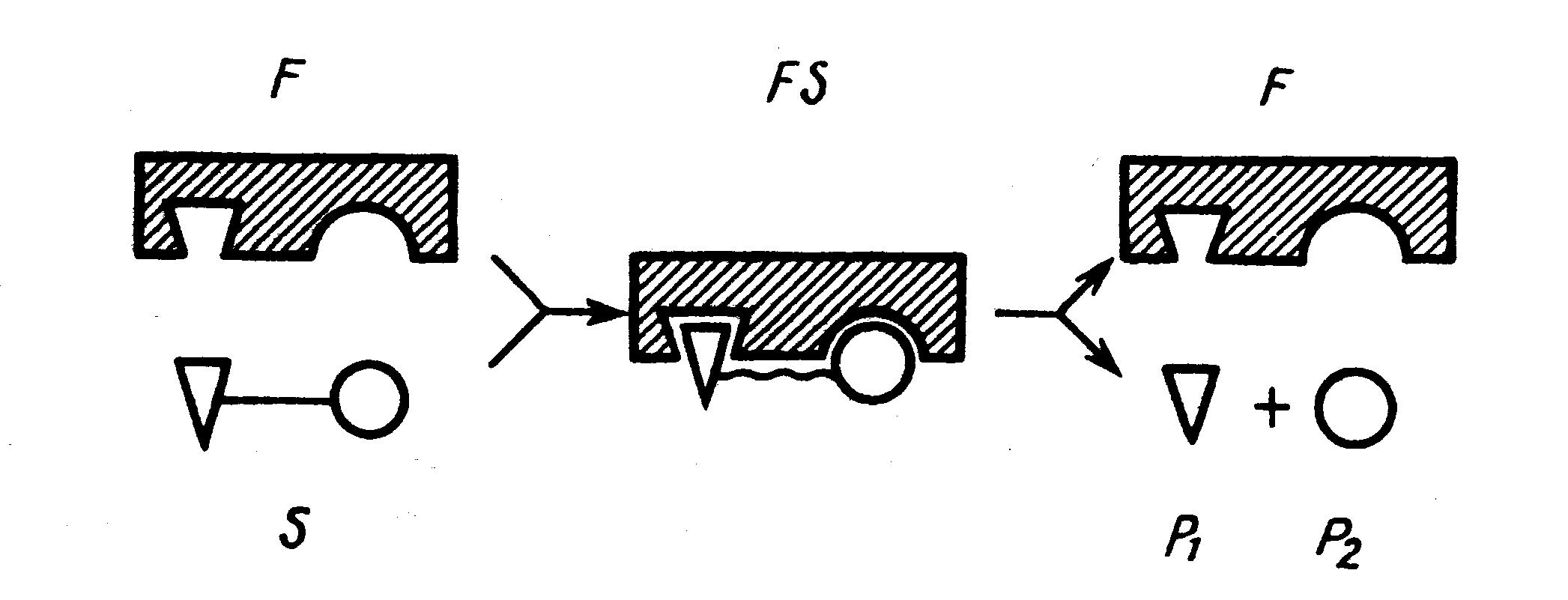
Рис. 4.2. Схема утворення фермент-субстратного комплексу
Як приклад, можна привести механізм дії фумарази (F), яка каталізує реакцію утворення яблучної кислоти з фумарової кислоти:
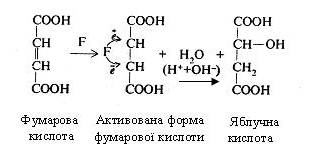
Подвійний зв'язок, що є у фумаровій кислоті, представлений електронними парами. При взаємодії фумарової кислоти з фумаразою відбувається утворення фермент-субстратного комплексу, у результаті чого функціональні групи активного центру ферменту сприяють перерозподілові електронів подвійного зв'язку. Внаслідок цього один з вуглецевих атомів здобуває електрон і заряджається негативно, а інший, віддаючи електрон, - позитивно. Таким чином, молекула фумарової кислоти стає активованою і легко може приєднувати іони Н+ і ОН- (іони води) за типом електростатичного зв'язку і перетворитися в яблучну кислоту.
У фермент-субстратному комплексі одночасно відбуваються два процеси: зміна його електронної густини, що викликає поляризацію зв'язків, а також геометрична деформація (напруга) окремих зв'язків як у молекулі субстрату, так і в активному центрі ферменту. Ці процеси сприяють подоланню активаційного бар'єра перехідного стану фермент-субстратного комплексу. На першій фазі ферментативного каталізу між субстратом і ферментом виникає сполука, у якій реагенти зв'язані один з одним ковалентним або іонним зв'язком. В другій фазі субстрат під впливом приєднаного до нього ферменту змінюється і стає більш доступним для відповідної хімічної реакції. На третій фазі відбувається сама хімічна реакція і, нарешті, продукти реакції, що утворилися, на четвертій фазі вивільняються з фермент-субстратного комплексу.
Якщо позначити фермент буквою F, субстрат - S, активований субстрат - S1 і продукт реакції - Р, то зазначену послідовність процесу можна виразити схемою:

Фермент зв'язується із субстратом в оборотній реакції з утворенням фермент-субстратного комплексу. У процесі утворення останнього і на подальших стадіях ферментативного каталізу відбуваються кількаразові зміни третинної структури ферменту, що приводять до послідовного зближення із субстратом і орієнтації в просторі тих активних груп, що взаємодіють одна з одною на різних етапах перетворення субстратів. Зміна третинної структури білка можлива тільки при участі всього (або майже всього) поліпептидного ланцюга, що утворює молекулу білка. Отже, у каталітичному процесі бере участь уся молекула ферменту при упорядкованій взаємодії його центрів, що забезпечує послідовне здійснення багатостадійних процесів ферментативного каталізу. Спрямованість реакцій залежить від зміни енергії при реакції, від різниці вільних енергій вихідних речовин і речовин, що утворюються.
Існує ще одна особливість дії ферментів: в організмі перетворення речовин до кінцевих продуктів відбувається в кілька етапів, кожний з яких каталізується окремим ферментом. Наприклад, синтез жирних кислот забезпечується групою ферментів, до складу якої входить сім ферментів.
Сума енергії активації проміжних реакцій нижче енергії активації, необхідної для одночасного розщеплення субстрату.
Адсорбційна теорія. Відповідно до цієї теорії, речовини, що реагують, адсорбуються на поверхні ферменту, що сприяє збільшенню їхньої концентрації, зближенню реакційноздатних груп. Речовини, що знаходяться на поверхні ферменту (адсорбенту), можуть утримуватися за рахунок простої фізичної адсорбції, обумовленої силами міжмолекулярної взаємодії і більш міцного хімічного зв'язку. Каталізатор своїм силовим полем викликає визначені зміни в структурі реагуючих речовин, що приводить до підвищення реакційної здатності субстрату і збільшенню швидкості реакції.
Кожен фермент містить певні хімічні угруповання, завдяки яким він вступає в з'єднання із субстратом і здійснює свою каталітичну дію.
Такими групами є SH-групи, залишки гістидину, серину, тирозину і т.д. Ці групи розташовані в молекулі ферменту на різних ділянках, але взаємодіють між собою і є відповідальними за каталітичну діяльність ферменту. Ці групи одержали назву функціональних груп ферментів.
У молекулі ферменту є комбінація різних хімічних угруповань, що утворюють активний центр у молекулі ферменту, завдяки якому здійснюється його каталітична дія.
Якщо в субстраті є заряджені групи, утворення FS-комплексу відбувається завдяки електростатичній взаємодії іонних зв'язків між позитивно зарядженими групами ферменту, і навпаки.
Якщо субстрат не має заряджених груп, то приєднання ферменту до субстрату відбувається внаслідок утворення водневих зв'язків або гідрофобної взаємодії.
Кофактори, виконуючи каталітичну функцію, залишаються хімічно незмінними в результаті каталітичної реакції.
