
- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
4.3. Властивості ферментів
Усі ферменти є високомолекулярними біополімерами. Білкова природа ферментів визначає ряд особливостей, що відрізняють їх від неорганічних каталізаторів.
Найважливіша особливість дії ферментів полягає в специфічності, що обумовлює вибірковість їхньої дії. Досить змінити просторове розташування атомів субстрату, щоб фермент не впливав на нього. Фермент може каталізувати одну або групу реакцій, близьких за своєю природою.
Завдяки своїй специфічності ферменти вибирають з ряду термодинамічно можливих хімічних реакцій лише деякі і тому не тільки прискорюють біохімічні перетворення, але і часто визначають загальний напрямок метаболічних процесів.
У залежності від того, чи може фермент каталізувати яку-небудь одну реакцію (тобто діяти на даний субстрат) або кілька реакцій (тобто діяти на визначену групу субстратів), розрізняють специфічність абсолютну і відносну.
Абсолютна специфічність характерна для ферментів, що діють на один субстрат з цілком визначеною структурою. Будь-які зміни в структурі субстрату роблять його недоступним для дії ферменту.
До таких ферментів відносять уреазу, яка каталізує розпад сечовини і не діє ні на які інші сполуки, навіть на похідні сечовини, наприклад метилсечовину. До цієї групи ферментів відноситься також аргіназа, що розщеплює аргінін в природних умовах.
Відносну специфічність мають ферменти, що діють на визначений вид зв'язку. Наприклад, пептидази гідролізують усі сполуки, що мають у своєму складі пептидний зв'язок -СО-NH.
Ферменти, що мають відносну специфічність, мають широкий спектр дії. Відносна групова специфічність характерна для ферментів, що діють на субстрати, що мають однаковий тип зв'язку і певне функціональне угрупування. Вони не тільки впливають на той або інший тип хімічного зв'язку, але і допускають зміни хімічної структури субстрату. Наприклад, ліпази і естерази розщеплюють як різні триацилгліцероли (жири), так і диацилгліцероли, моноацилгліцероли і складні ефіри. Однак розщеплення цих субстратів відбувається з різною швидкістю.
Деякі ферменти діють на субстрати, що мають тільки визначену просторову конфігурацію, тобто виявляють просторову, оптичну, стереоізомерну специфічність. Наприклад, ферменти дріжджової клітки каталізують зброджування - розпад D-глюкози з утворенням етилового спирту і оксиду карбогену, але не впливають на L-глюкозу. Стереоізомірна специфічність визначається не тільки D і L, але й іншими типами ізомерії. Фермент, що діє на субстрат з цис-конфігурацією, як правило, не атакує трансізомер даної сполуки, і навпаки.
З інших властивостей ферментів варто вказати на оборотність їхньої дії.
У залежності від концентрації вхідних і кінцевих продуктів реакції ферменти можуть каталізувати як прямі, так і зворотні реакції, тобто викликати як процеси синтезу, так і процеси розпаду. Вперше на цю особливість звернув увагу видатний російський хімік А. Я. Данилевський (1886 р.). Він показав, що фермент шлункового соку пепсин, що розщеплює білки на пептони і альбумози (уламки білкової молекули), у певних умовах може каталізувати синтез білків з цих проміжних продуктів обміну білків. Однак пізніше було доведено, що зворотність дії характерна не для усіх ферментів.
Багато процесів розпаду і синтезу відбуваються не тільки під дією різних ферментів, але і за іншим механізмом. У живому організмі розщеплення і синтез здійснюються в більшості випадків різними ферментами навіть тоді, коли даний фермент здатний каталізувати реакцію в різних напрямках. У синтезі беруть участь ферменти, що використовують енергію гідролізату АТФ і деяких інших сполук. Так, при гідролізі глікогену в печінці за допомогою амілази і мальтази утворюється глюкоза. З глюкози там же, у печінці, синтезується глікоген, але його утворення не є наслідком зворотної реакції гідролізу, а відбувається більш складним шляхом.
Для ферментів характерна чутливість до зміни температури (термолабільність), особливо до її підвищення. Висока температура, яка денатурує білки, інактивує ферменти (рис. 4.1.).
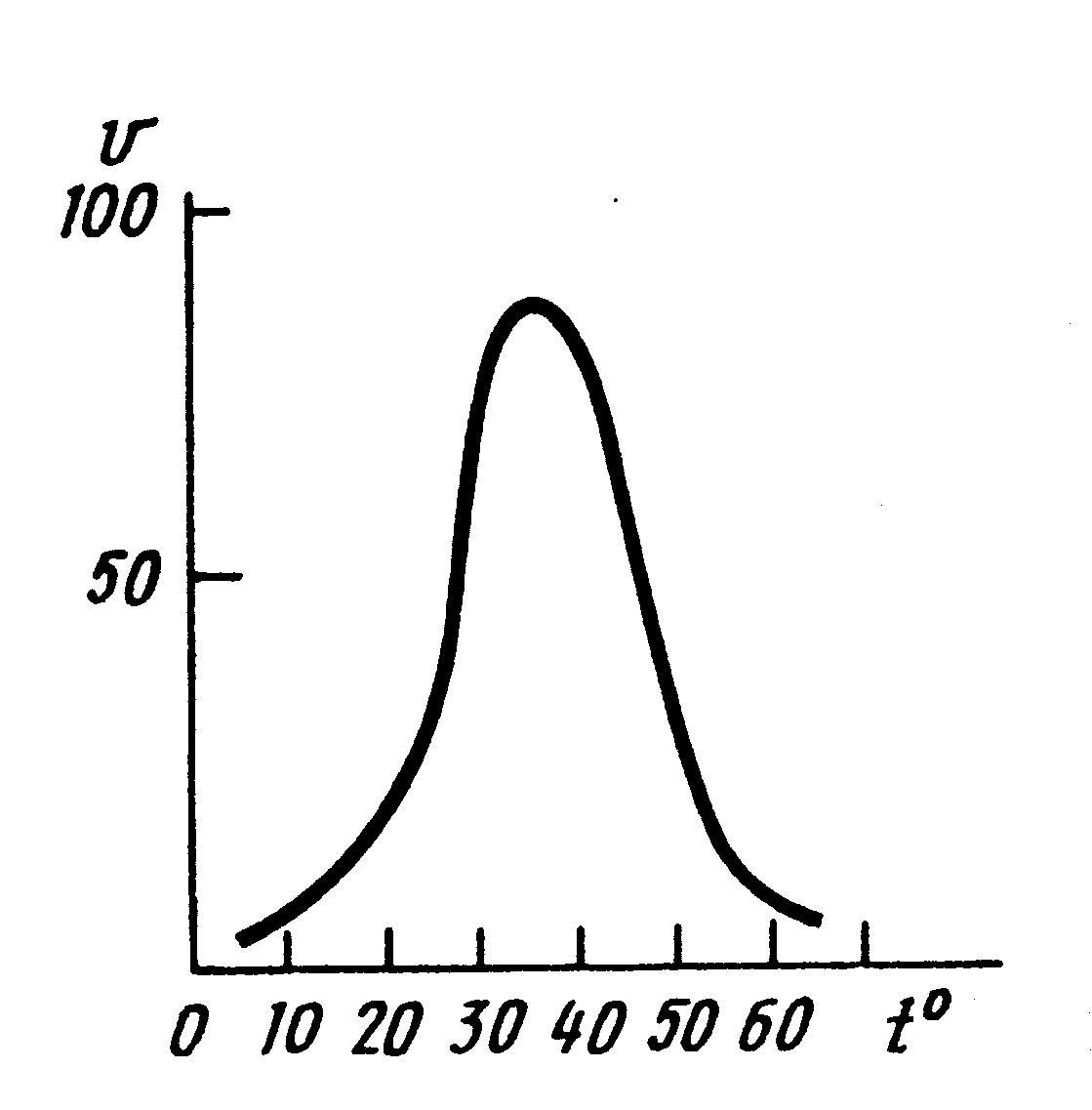
Рис 4.1. Термолабільність ферментів
Встановлено, що ферменти тваринного походження виявляють найбільшу активність при температурі 37-400С, а рослинного - при 50 і 60°С. Таку температуру називають температурним оптимумом (мал. 4.1.). Однак є виключення, наприклад, каталаза найбільш активна при температурі 0-100С.
Нагрівання до температури 50-600С послабляє дію ферментів тваринного походження. При температурі 70°С і вище більшість з них цілком втрачає свою активність. При зниженій температурі (гіпотермія) активність ферментів знижується, але не зникає. Встановлено, що в холодильних камерах у замороженому м'ясі відбувається повільне розщеплення білків під дією протеолітичних ферментів. Коли для ферментів створюється температурний оптимум, вони знову стають активними. Прикладом може служити зимове спання тварин. Цю здатність ферментів використовують у хірургії, кріобіології.
На активність ферментів впливає певна концентрація водневих іонів - рН середовища. Для кожного ферменту існує визначена вузька межа рН середовища, що є оптимальним для реалізації його максимальної активності. Відхилення рН від оптимального значення приводить до зниження активності ферменту або навіть до його необоротної інактивації. Оптимальне значення рН середовища складає для пепсину 1,5-2,5, трипсину - 8,0-8,5, амілази слини - 6,8-7,4, аргінази - 9,7.
Зміни в каталітичній дії ферментів при різних значеннях рН середовища можуть бути зв'язані зі змінами конфігурації унікальної структури молекули - її активного центра.
Швидкість ферментативних реакцій залежить не тільки від температури і рН середовища, але і від концентрації ферменту і субстрату, наявності активаторів і паралізаторів.
Швидкість дії ферменту визначається концентрацією фермент-субстратного комплексу, що утвориться. Максимальна швидкість реакції досягається тоді, коли концентрація субстрату буде достатня, щоб зв'язати всю кількість ферменту у фермент-субстратний комплекс.
Крім зазначених факторів, на активність ферментів впливає присутність у розчині ряду хімічних сполук, що можуть активувати (активатори) або гальмувати (інгібітори) дію ферментів. Активатори представлені іонами багатьох металів (найбільше часто Mg2+, Мn2+, К+, Со2+), деякими аніонами (Сl-). Так, амілаза слини і підшлункової залози активуються аніонами хлору; дія ліпази соку підшлункової залози стимулюють жовчні кислоти.
Механізм активації ферментів іонами металів полягає в тому, що в одних випадках вони входять до складу простетичної групи ферментів і полегшують утворення фермент-субстратного комплексу, а в інших - сприяють приєднанню коферменту до апоферменту або забезпечують утворення четвертинної структури ферменту.
Прості хімічні сполуки діють як алостеричні активатори. Приєднуючись до алостеричного центра ферменту, вони змінюють третинну структуру білкової молекули. У результаті цього активний і субстратзв’язуючий центри ферменту здобувають найбільш вигідну для взаємодії із субстратом конфігурацію.
Деякі ферменти виробляються в неактивній формі у виді проферментів, або ензимогенів (попередників). Їхній активний центр замаскований додатковою ділянкою поліпептидного ланцюга, тому субстрат не може з ним з'єднатися. Видалення такої додаткової ділянки приводить до вивільнення активного центру і можливості утворення фермент-субстратного комплексу. Так, профермент пепсину - пепсиноген активується соляною кислотою з відщіпленням невеликого пептидного ланцюга. У результаті утворюється активний протеолітичний фермент - пепсин.
Інгібітори гальмують дію ферментів. Розрізняють два види інгібування: незворотне й зворотне. Незворотне інгібування зв'язано з дією таких речовин, що порушують усю структуру ферменту, у тому числі активного центру (наприклад, дія сильних кислот і основ, солей важких металів).
Зворотне інгібування відбувається в період безпосередньої взаємодії ферменту з інгібітором, видалення якого знову повертає ферментові активність. Таке інгібування може протікати за конкурентним і неконкурентним типом.
Конкурентне гальмування можливе в тому випадку, коли інгібітор містить хімічні групи, подібні із субстратом, тобто є його структурним аналогом і здатний взаємодіяти з активним центром ферменту. В основі цього виду гальмування лежить конкуренція між субстратом і інгібітором за приєднання до активної групи ензиму. Такий інгібітор, зв'язуючись з ферментом, утворює інгібітор-ферментний комплекс. Однак це відбувається лише у випадку, якщо концентрація інгібітору перевищує кількість субстрату.
При збільшенні концентрації субстрату він витісняє інгібітор з активного центра ферменту, що відновлює свою каталітичну функцію. Таким чином, дія конкурентних інгібіторів може бути ослаблена або усунута шляхом збільшення кількості субстрату.
При неконкурентному гальмуванні інгібітор взаємодіє не з активним субстратним центром ферменту, а з алостеричним. Внаслідок цього змінюється структура ферменту, у тому числі й активного центру, до якого вже не може приєднатися субстрат. У цьому випадку концентрація інгібітору не має ніякого значення. Видалення інгібітору не завжди приводить до відновлення властивостей ферменту.
Інгібітори ферментів зустрічаються в тканинах організму. У підшлунковій залозі виявлена речовина білкової природи, що гальмує активність трипсину. Відома також сполука, що гальмує активність пепсину. Ці речовини називають антиферментами, їхня дія носить зворотний характер. У визначених умовах антиферменти відщеплюються від ферментів, що веде до відновлення активності останніх.
