
- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
Тести для контролю знань і самопідготовки
Що таке білки?
|
а) білки є високомолекулярними полімерами, що побудовані із АК, зв’язаних пептидними зв’язками |
|
б) білки це високомолекулярні азотовмісні сполуки, що утворюють колоїдні розчини |
|
в) білки є поліконденсатами АК |
|
г) білки - це гетерогенні високомолекулярні сполуки мононуклеотидів |
Які елементи входять до складу білків?
|
а) карбоген, гідроген, оксиген, сірка |
|
б) карбоген, гідроген, оксиген, фосфор |
|
в карбоген, гідроген, оксиген, нітроген, сірка, фосфор, залізо |
|
г) карбоген, оксиген, сірка, фосфор, йод, залізо |
Які АК належать до моноамінодикарбонових?
|
а) Ліз, НО Ліз, Арг, Орн |
|
б) Глу, Асп |
|
в) Ала, Вал, Лей, Ілей |
|
г) Глу, Асп, Ліз, Арг |
Які АК є постійною складовою частиною білків?
|
а) Ала, ГАМК |
|
б) Цис, Цин, Орн, Цит, Гомоцистеін |
|
в) Вал, Ала, Сер, Глу |
|
г) Орн, Карнозин, карнітин, ансерин |
Які Ак містять сірку?
|
а) Сер, Тир, Тре, Цис |
|
б) Вал, Лей, Іле, Тре |
|
в) Три, Гіс, Про |
|
г) Мет, Цис, Цин |
Яка ак має таку формулу:
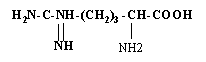
|
а) Цис |
|
б) Лей |
|
в) Орн |
|
г) Арг |
Які ак мають такі формули :
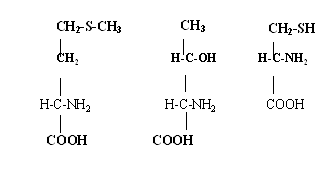
|
а) Сер, Лей, Мет |
|
б) Тре, Сер, Гіс |
|
в) Мет, Тре, Цис |
|
г) Цис, Мет, Тре |
Які групи постійно містяться в АК?
|
а) аміногрупа, карбоксильна |
|
б) аміногрупа, гідроксильна |
|
в) карбоксільна, метильна |
|
г) аміногрупа, метильна, гідроксильна |
Яка Ак є диамінодикарбоновою?
|
а) Цис |
|
б) Ала |
|
в) Мет |
|
г) Гіс |
Які АК мають по дві карбоксильні групи?
|
а) Про, Сер, Мет |
|
б) Вал, Ілей, Тре |
|
в) Арг, Ліз, Вал |
|
г) Глу, Асп |
Яка АК має сульфгідрильну групу?
|
а) Цис |
|
б) Гли |
|
в) Мет |
|
г) Сер |
Які АК не мають аміногрупу і тому називаються імінокислотами?
|
а) Тир, Фен |
|
б) НО-Ліз |
|
в) Три, Арг |
|
г) Про, НО-Про |
Які АК мають основні властивості?
|
а) Ліз, Арг |
|
б) Лей, Ілей |
|
в) Про, НО-Про |
|
г) Вал, Цин |
Які АК мають гідроксильну групу?
|
а) Фен, Ліз |
|
б) Мет, Цис |
|
в) Тре, Сер |
|
г) Асп, Глу |
Якими групами зв’язані АК у пептидному ланцюзі?
|
а) карбоксильними, гідроксильними та аміногрупами |
|
б) карбоксильна група однієї АК зв’язана з аміногрупою іншої |
|
в) сульфгідрильними групами |
|
г) водневими, ковалентними, електронними та іншими зв’язками |
Що таке первинна структура білків?
|
а) унікальна послідовність АК-залишків у поліпептидному ланцюзі |
|
б) кількісний склад АК у молекулі білка |
|
в) розташування поліпептидного ланцюга у просторі |
|
г) певне чергування внутрішньомолекулярних зв’язків у білках |
Що є характерним для вторинної структури білків?
|
а) взаємне розташування поліпептидних ланцюгів всередині білкової молекули з утворенням спіралей |
|
б) конформаційні взаємозв’язки пептидних ланцюгів |
|
в) просторова конфігурація поліпептидного ланцюга в білковій молекулі |
|
г) просторова спіралевидна конфігурація поліпептидного ланцюга |
Що таке третинна структура білків?
|
а) взаємне розташування активних груп АК у пептидному ланцюзі |
|
б) просторова упаковка спіралей, тобто вторинних структур у молекул активного білка |
|
в) активна структура білка, зумовлена водневими зв’язками пептидних ланцюгів |
|
г) асоціація білкових і небілкових субодиниць у макромолекулах білків |
Що таке четвертинна структура білків?
|
а) об’єднання декількох білкових одиниць і небілкових молекул третинної структури в активні білкові міцели |
|
б) конформаційні структури білка |
|
в) розташування вторинних структур у просторі білкової молекули |
|
г) специфічна конформація, характерна для білків з відносно низькою молекулярною масою |
Що означає термін „конформація білка”?
|
а) це асоціація двох, або більше третинних структур у макромолекулі білка |
|
б) сума всіх зв’язків у білкових молекулах |
|
в) просторова біологічна активна архітектоніка білкової молекули, утворена за певних умов середовища |
|
г) розташування активних груп білка в тримірному просторі за певних значень рН середовища |
Для яких білків характерні β-спіральні структури?
|
а) фібрилярних (колаген, кератин) |
|
б) глобулярних |
|
в) багатих про і НО-про |
|
г) багатих глу та арг |
Які білки мають структуру статичного клубка?
|
а) переважно фібрилярні |
|
б) переважно глобулярні |
|
в) скорочувальні |
|
г) нерозчинні кератини |
Що таке денатурація білків?
|
а) повна втрата білками гідрофобних властивостей і здобуття гідрофільних |
|
б) повна втрата білками нативних властивостей з подальшим порушенням їх специфічної макроструктури |
|
в) значне порушення всіх ковалентних зв’язків у білковій молекулі |
|
г) порушення первинної структури білків за збереженням унікальної укладки поліпептидного ланцюга у просторі |
Чому розчинні білки є колоїдними?
|
а) тому, що розмір білкових часток не перевищує 1 мм (10-9 м) |
|
б) мають високу молекулярну масу, розмір білкових часток коливається від 0,001 до 0,1 мкм (10-6-10-9 м) |
|
в) мають низьку в’язкість і високий осмотичний тиск |
|
г) мають гідрофобні властивості |
Що таке діаліз білків?
|
а) відсутність у білкових часток здатності проникати через напівпроникні мембрани |
|
б) розщеплення білків на АК |
|
в) здатність білкових часток проходити через напівпроникні мембрани |
|
г) переміщення білкових молекул до анода |
Полярні позитивно зарядженні амінокислоти
|
а) Вал, Лей, Іле, Мет, Фен, Три, Про, Ала |
|
б) Гли, Сер, Цис, Асп, Тре, Глу, Тир |
|
в) Асп, Глу |
|
г) Лиз, Арг, Гис |
