
- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
Рівні організації білкової молекули
При розгляді структури білкової молекули прийнято розрізняти чотири рівні її організації: первинну, вторинну, третинну і четвертинну.
Первинна структура білка. Під первинною структурою розуміють число і послідовність амінокислотних залишків у поліпептидному ланцюзі (мал. 2.1). Вона визначається: 1) природою вхідних у білок амінокислот; 2) кількістю кожної амінокислоти; 3) строго визначеною амінокислотною послідовністю поліпептидного ланцюга.
Небілкові (простетичні) групи також включаються в первинну структуру білка. Основним типом хімічного зв'язку первинної структури є пептидний зв'язок. Ряд білків має невелике число дисульфідних зв'язків.
Кожен білок характеризується унікальною первинною структурою, обумовленою на генетичному рівні. В даний час установлено, що біологічна активність білка і його загальна конформація визначаються амінокислотною послідовністю. Заміна амінокислоти в поліпептидному ланцюзі може привести як до структурних змін молекул білка, так і до змін його фізико-хімічних властивостей і біологічних функцій.

Малюнок 2.1. Первинна структура рибонуклеази
Вторинна структура білка. Під вторинною структурою поліпептидного ланцюга розуміють упорядковане просторове розташування окремих її ділянок. У природних білках визначається два основних типи вторинної структури: -спіраль і -структура (складчасті шари). Основним хімічним зв'язком, що підтримує вторинну структуру, є водневий зв'язок. У -спіралі диполі сусідніх пептидних зв'язків (кожна -С=О-група має водневий зв'язок з четвертою за ходом ланцюга -NH-групою) утворюють велику систему внутрімолекулярних кооперативних водневих зв'язків, що стабілізують спіральну конформацію поліпептидного ланцюга. Бічні ланцюги амінокислот у -спіралі спрямовані назовні від центральної осі. -структура також стабілізується кооперативними міжпептидними водневими зв'язками в межах окремих ділянок одного поліпептидного ланцюга (у глобулярних білках) або між суміжними ланцюгами (у фібрилярних білках).
У більшості природних білків високо структуровані ділянки ланцюга чергуються з ділянками без вираженої вторинної структури.
Третинна структура білка. Третинна структура поліпептидного ланцюга визначає характер укладання спіральних і лінійних ділянок у даному обсязі (мал. 2.2). Укладання ланцюга в просторі відбувається з великою точністю: той або інший поліпептидний ланцюг за певних умов згортаються тільки одним-єдиним способом, здобуваючи ту форму, що характерна для молекул даного нативного (природного) білка. Завдяки такій строгій закономірності білок може цілком виконувати своє функціональне призначення.
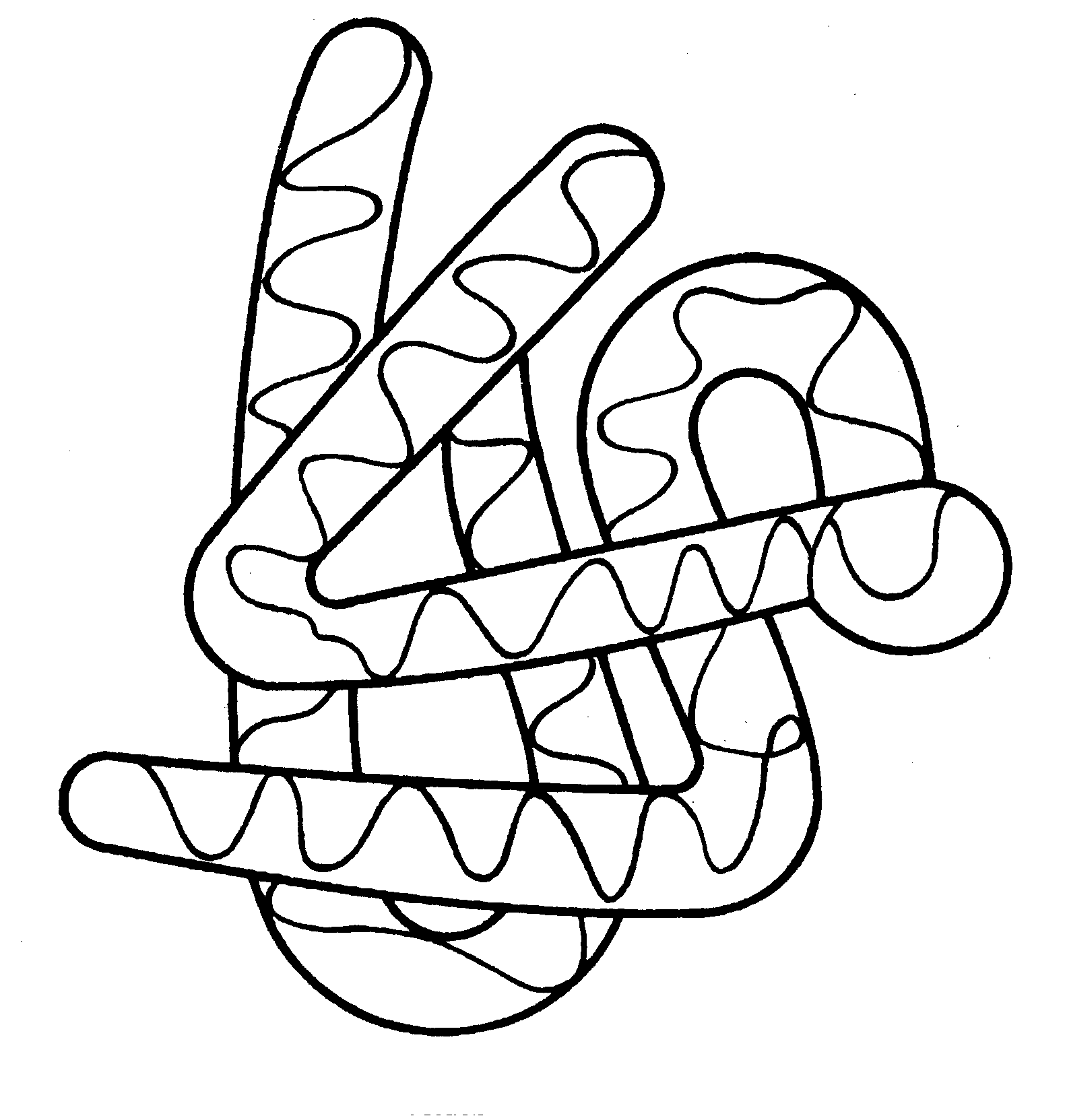
Малюнок 2.2 Схематичне зображення тримірної структури міоглобіну
Форма молекул білка буває різною: від кулястої до нитковидної; за цією ознакою білки поділяються на глобулярні і фібрилярні (нитковидні). У глобулярних - третинна структура характеризується досить щільним упакуванням ланцюга у виді клубка.
Четвертинна структура білка. Четвертинна структура характерна для тих білків, молекула яких складається з двох і більш поліпептидних ланцюгів (субодиниць). Причому найчастіше зустрічаються димери, тримери і тетрамери. Стабілізацію четвертинної структури забезпечують нековалентні взаємодії між амінокислотними залишками, розташованими поблизу поверхні кожної глобули. З білків такого типу найбільш вивчений гемоглобін (мал.2.3). Він є типовим представником білків, що мають четвертинну структуру. Його молекула побудована з чотирьох попарно однакових субодиниць – двох - та двох -поліпептидних ланцюгів, кожен з яких з’єднаний з небілковою сполукою гемом – порфіриновим похідним, що зв’язує молекулу оксигену.
Білки з четвертинною структурою можуть включати як однакові протомери (як у прикладі гемоглобіну), так і різні. У складі багатьох білків-ферментів містяться різні протомери, що виконують різні біохімічні функції (зокрема, каталітичну та регуляторну).
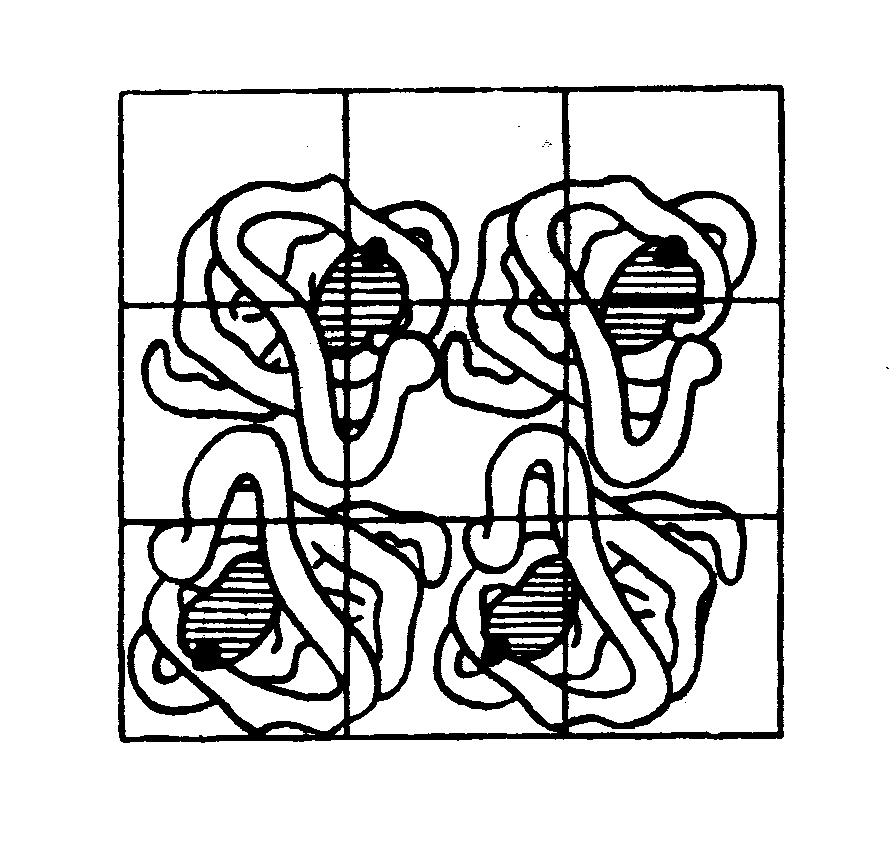
Малюнок 2.3. Четвертинна структура гемоглобіну
Молекула білка в четвертинній структурі - це взаємне просторове розташування глобул, що представляють собою єдине ціле в структурному і функціональному сенсі.
Четвертинній структурі належить важлива роль у регуляції біологічної активності білків, тому що вона дуже чуттєва до зовнішніх впливів, що викликають зміну взаєморозташування субодиниць і, як наслідок, - зміну активності білка. Таким чином, для кожного білка характерна своя просторова структура - конформація. У її формуванні ведуча роль належить первинній структурі, обумовленою інформацією, яка зберігається в ДНК. Нативні структуровані білкові молекули мають великий ступінь упорядкованості в порівнянні з розгорнутою поліпептидною ниткою. Спіралізація лінійного пептичного ланцюга (утворення вторинної структури) зменшує її розміри приблизно в 4 рази, а укладання в третинну структуру робить її в десятки разів більш компактною, ніж вихідний поліпептидний ланцюг.
Є домени - глобулярні утворення всередині білків із третинною структурою. Діаметр глобулярного домену дорівнює в середньому 2,5 нм; до його складу входить 100-150 амінокислотних залишків. Окремі домени є функціонально відносно автономними утвореннями в складі білкових молекул, і доменні білки в цьому відношенні подібні до олігомерних білків. Але, на відміну від білків із четвертинною структурою (олігомерів), окремі доменні глобули утворюються тим самим поліпептидним ланцюгом і, відповідно, зв’язані між собою пепетидними фрагментами (“шарнірними” ділянками). З’вязки між доменами можна розщепити тільки за допомогою протеолітичних ферментів.
Прикладами доменних білків є ферменти гліколітичного шляху окиснення глюкози, у складі яких окремі домени реалізують різні етапи складного каталітичного акту.
