
- •Павлоцька л.Ф., дуденко н.В., димитрієвич л.Р., божко н.В. Біологічна хімія суми – 2008
- •Передмова
- •Розділ 1. Біохімічна характеристика живих організмів
- •1. 1. Хімічний склад організму людини
- •1. 2. Структура клітини
- •1.3. Роль обміну речовин у життєдіяльності організму
- •1.4. Значення харчових факторів у забезпеченні процесів життєдіяльності
- •Контрольні питання і завдання.
- •Тести для контролю знань і самопідготовки
- •6. Які елементи складають понад 98% маси біосфери?
- •Розділ 2. Хімія білків
- •2.1. Біологічна роль білків
- •2. 2. Амінокислоти
- •Стереоізомерія амінокислот
- •Фізико-хімічні властивості амінокислот
- •Амінокислотний склад білків
- •2.3. Біологічна роль окремих амінокислот
- •2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
- •Типи хімічних зв'язків у білковій молекулі
- •Рівні організації білкової молекули
- •2.5. Фізико-хімічні властивості білків
- •Амфотерні властивості білків
- •Розчинність білків
- •Денатурація білків
- •2.6. Класифікація й характеристика білків
- •Прості білки
- •Складні білки
- •2.7. Біологічна цінність білків
- •2.8. Білки харчової сировини
- •Білки субпродуктів
- •Білки молока
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка ак має таку формулу:
- •Які ак мають такі формули :
- •Формула треоніну:
- •Формула гістидину:
- •Із яких компонентів складаються хромопротеіни?
- •Фактори, що викликають незворотні зміни білків:
- •Яка з структур білка тіла людини є найбільш поширена:
- •Формула лізину:
- •Розділ 3. Хімія нуклеїнових кислот Загальна характеристика
- •Хімічний склад і будова
- •Тести для контролю знань і самопідготовки
- •Які азотисті основи мають такі формули?
- •Розділ 4. Ферменти
- •4.1. Загальне поняття про ферменти
- •4.2. Будова ферментів
- •4.3. Властивості ферментів
- •4.4. Загальні уявлення про механізм дії ферментів
- •4.5. Регуляція ферментативних реакцій
- •4.6. Номенклатура й класифікація ферментів
- •4.7. Використання ферментів в харчовій промисловості
- •Характеристика оксидоредуктаз і використання ферментів у виробництві харчової продукції
- •Використання ферментів в технологіях харчових речовин
- •Тести для контролю знань і самопідготовки
- •50. Який кофермент має таку формулу?
- •Розділ 5. Хімія ліпідів
- •5.1. Біологічна роль, будова й властивості ліпідів й їхніх похідних
- •5.2. Прості ліпіди
- •5.3. Складні ліпіди
- •Тести для контролю знань і самопідготовки
- •2. Чим відрізняються складні ліпіди від простих?
- •4. Який ліпід має таку формулу?
- •5. Які функції виконують ліпіди?
- •До складу яких фосфоліпідів входять таки азотисті основи:
- •Розділ 6. Хімія вуглеводів
- •6.1. Біологічна роль, будова, властивості вуглеводів й їхніх похідних
- •6.2. Утворення вуглеводів у процесах фотосинтезу
- •6.3. Використання вуглеводів у харчовій промисловості
- •Тести для контролю знань і самопідготовки
- •Який моносахарид належить до тріоз?
- •8. Які формули мають пентози?
- •Які олігосахариди є дисахаридами?
- •Який дисахарид має таку формулу?
- •Який дисахарид має таку формулу?
- •Який олігосахарид утворюється під час ферментативного гідролізу крохмалю?
- •Які вуглеводи належать до полісахаридів?
- •Розділ 7. Енергетичні процеси в організмі
- •7.1. Біологічне окиснювання
- •7.2. Роль окислювально-відновних ферментів у біологічному окиснюванні
- •7.3. Транспорт електронів і протонів при біологічному окиснюванні
- •7. 4. Окисне фосфорилюванння
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 8. Вітаміни
- •8. 1. Загальне поняття про вітаміни і їхня класифікація
- •Класифікація вітамінів
- •8. 2. Водорозчинні вітаміни
- •8. 3. Жиророзчинні вітаміни
- •8. 4. Вітаміноподібні сполуки
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 9. Регуляція обміну речовин в організмі
- •9.1. Загальні уявлення про регуляцію обміну речовин
- •9.2. Роль нервової системи в регуляції обміну речовин
- •9.3. Роль гормонів у регуляції обміну речовин
- •9.4. Класифікація гормонів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука має таку формулу?
- •Яка речовина має таку формулу?
- •Яку формулу має гістамін?
- •6. Які процеси регулюють мінералокортикоіди?
- •Яка речовина має таку формулу:
- •Яку формулу має серотонін?
- •Розділ 10. Обмін білків
- •10.1. Біологічне значення білкового обміну
- •10.2. Переварювання білків у травному тракті
- •10.3. Утворення в кишечнику отрутних продуктів розпаду білків й їхнє знешкодження
- •Шляхи обміну амінокислот
- •Дезамінування амінокислот
- •Трансамінування (переамінування) амінокислот
- •Декарбоксилювання амінокислот
- •10.5. Процеси знешкодження аміаку
- •10.6. Обмін хромопротеїнів
- •10.7. Обмін нуклеїнових кислот в організмі
- •Утворення сечової кислоти
- •10.8. Біосинтез білка
- •10.9. Регуляція біосинтезу білка
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Яка сполука утворюється з амінокислот при відбудовному дезамінуванні?
- •Розділ 11. Обмін вуглеводів
- •11.1. Розщеплення вуглеводів у травному тракті людини
- •11.2. Регуляція обміну вуглеводів і його порушення
- •11.3. Проміжний обмін вуглеводів
- •Аеробне окиснювання вуглеводів
- •Цикл трикарбонових кислот (цикл Кребса)
- •Пентозний цикл окиснювання вуглеводів
- •Види бродіння
- •Контрольні завдання і питання
- •Тести для контролю знань і самопідготовки
- •Яким чином утворилася така сполука?
- •Яка сполука має таку формулу?
- •Які сполуки мають такі формули:
- •Розділ 12. Обмін ліпідів
- •12.1. Розщеплення ліпідів у травному тракті людини
- •12.2. Обмін ліпідів у тканинах
- •Метаболізм кетонових (ацетонових) тіл
- •12.3. Біосинтез ліпідів
- •12.4. Регуляція обміну ліпідів і його порушення
- •12.5. Псування ліпідів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •Розділ 13. Біохімічні та інші зміни, що відбуваються з основними речовинами в процесі зберігання і технологічної обробки харчової продукції
- •13.1.Зміна стану та вмісту води
- •13.2. Зміни вмісту мінеральних речовин
- •Втрати мікроелементів при варінні бобових
- •13.3. Зміни стану та вмісту білків
- •Вплив тривалості варіння на перехід колагену в глютин, %
- •Вплив температури і тривалості варіння на перехід колагену в глютин, %
- •Чинники, що впливають на емульгування жиру
- •Кількість отриманого жиру в залежності від режимів обробки кістки
- •Температура димоутворення різних жирів
- •13.5. Зміни углеводів
- •Контрольні питання і завдання:
- •Тести для контролю знань і самопідготовки
- •6. Які структурні компоненти харчових продуктів скорочують втрати вологи в сировині при тепловій обробці ?
- •31. Під дією яких процесів утворюється інвертний цукор?
- •Список рекомендованої літератури
2.4. Будова й структурна організація білкової молекули Поліпептидна будова білків
Амінокислоти приєднані одна до одної ковалентним амідним зв'язком, що виникає при взаємодії -карбоксильної групи однієї амінокислоти з -аміногрупою іншої амінокислоти. При цьому виділяється вода. Продукти такої реакції називаються пептидами, а сам зв'язок між амінокислотами отримав назву пептидного.
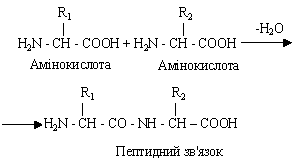
У пептидів на одному кінці - вільна аміногрупа, а на іншому - карбоксильна. До цих груп можуть приєднуватися нові амінокислоти, завдяки чому відбувається нарощування пептидного ланцюга.
За числом амінокислотних залишків розрізняють дипептиди, трипептиди, тетрапептиди і т.п. Пептиди, що містять від двох до десяти залишків, називаються олігопептидами. Пептиди, що складаються більш ніж з десяти залишків амінокислот, відносяться до поліпептидів.
Початком поліпептидного ланцюга прийнято вважати амінокислоту з вільною -аміногрупою (N - кінцева амінокислота), кінцем - амінокислоту з вільною карбоксильною групою (С - кінцева амінокислота). Найменування пептидів складається з назви першої амінокислоти з типовим для ацилів закінченням -іл, назв наступних амінокислот (також із закінченням -іл) і повної назви останньої амінокислоти (закінчення не змінюється). Наприклад, зображений нижче тетрапептид називається гліцил-аргініл-глутаміл-аланін, або скорочено Глі-Арг-Глу-Ала.

Типи хімічних зв'язків у білковій молекулі
У біомолекулах хімічні зв'язки можна розділити на ковалентні і нековалентні. До ковалентних відносяться пептидний і дисульфідний зв'язки. Важливу роль у підтримці просторової структури біологічних молекул грають більш слабкі, чим ковалентні, хімічні зв'язки (водневі, гідрофобні взаємодії, ван-дер-ваальсові сили, іонні зв'язки).
Водневі зв'язки. Цей тип зв'язку з'являється при електростатичній взаємодії атома гідрогену з частково позитивним зарядом і ковалентно зв'язаного атома оксигену (нітрогену) з негативним зарядом. Здатність до утворення водневих зв'язків яскраво виражена в сполуках, що містять групи -СО, -NH, -ОН, -COO-, -СОН. Молекули білків можуть мати водневі зв'язки різних типів.
У білковій молекулі водневі зв'язки можуть утворюватися між угрупованнями пептидних ланцюгів і бічних ланцюгів амінокислот. Водневі зв'язки бувають внутрімолекулярними і міжмолекулярними. Одиничний водневий зв'язок досить слабкий і неміцний, однак утворення навіть декількох таких зв'язків, що діють кооперативно, являє собою стабілізуючий фактор.
Гідрофобні взаємодії. Сполуки, що несуть заряди, а також здатні до утворення водневих зв'язків, є полярними, або гідрофільними (від грец. hydor - вода і phіlіa - любов). Внаслідок того, що електронегативний заряд карбогену близький до гідрогену, карбоген не здатний до утворення водневих зв'язків. Зв'язки С-Н неполярні, тому вуглеводневі ланцюги гідрофобні (від грец. hydor - вода і phobos - острах). Молекули води, прагнучи утворити між собою водневі зв'язки, виштовхують гідрофобні групи і молекули, змушуючи їх перетворюватися в асоціати. Цей процес йде мимовільно. Гідрофобні асоціати мають першорядне значення для "архітектури" біомембран, нуклеїнових кислот і білків. У білках гідрофобні взаємодії виникають унаслідок прагнення неполярних гідрофобних бічних ланцюгів ряду амінокислот (Вал, Ала, Лей, Іле, Фен, Тир, Три) уникати контакту з водою. Поліпептидний ланцюг при цьому звертається як би в клубок, усередині якого зближаються гідрофобні угруповання, а на поверхні розташовуються полярні групи, взаємодіючі з водою.
Ван-дер-ваальсові сили. За своєю природою ці зв'язки нагадують водневі, тому що виникають на основі кулонівських сил електростатичного притягання. Однак, якщо в утворенні водневих зв'язків беруть участь постійні диполі високополярних ковалентних зв'язків, то ван-дер-ваальсові сили виникають при індукованих, непостійних диполях слабко полярних ковалентних зв'язків, наприклад С-Н. Незважаючи на те, що ван-дер-ваальсові сили дуже слабкі, вони фактично обумовлюють асоціацію багатьох неполярних угруповань у біомолекулах.
Іонні зв'язки. Даний тип заснований на взаємному електростатичному притяганні протилежно заряджених іонів. Прикладом такої взаємодії служить зв'язок між негативно зарядженою карбоксильною групою СОО- і позитивно зарядженою протонованою аміногрупою NH2+.
Найважливішою особливістю слабких хімічних зв'язків є те, що їхня енергія незначно перевищує кінетичну енергію теплового руху (2,5 кДж/моль). Цього невеликого перевищення виявляється досить, щоб виникли слабкі взаємодії як усередині, так і між біомолекулами. Такі неміцні вторинні хімічні зв'язки дуже лабильні, що обумовлює їхнє швидке виникнення і розпад.
